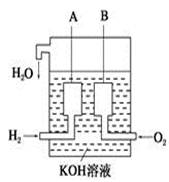
①非金属氧化物一定不是碱性氧化物 ②电解质溶液的导电过程伴随化学变化
③HCl既有氧化性又有还原性 ④Fe(OH)3、FeCl3、HNO3都不能用化合反应制备
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
| 选项 | ① | ② | ③ | 实验结论 | |
| A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si | |
| B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 | |
| C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 | |
| D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
10NaN3+2KNO3=K2O+5Na2O+16N2↑,下列判断正确的是
| A | B | C | D | |
| 实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
| 现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
②H2(g)+1/2O2(g) = H2O(l) ΔH2=-285.8 kJ·mol-1。
气态分子中的化学键 | 断开1 mol化学键所需的能量/kJ |
O—H | 465 |
O | 498 |
下列说法错误的是( )
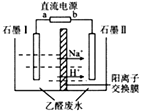
MnO4-+5e-+8H+→Mn2++4H2O;MnO4-+3e-+2H2O→MnO2+4OH-;MnO4-+e-→MnO42-。由此可知,高锰酸根离子(MnO4-)反应后的产物与有关。
实验1:探究Na2CS3的性质
|
步骤 |
操作及现象 |
|
① |
取少量Na2CS3 固体溶于蒸馏水配制成溶液并分成两等份 |
|
② |
向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
|
③ |
向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
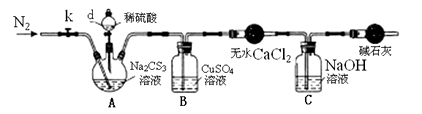
已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
盛放无水CaCl2的仪器的名称是。
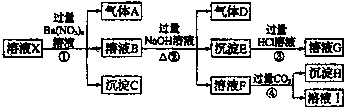
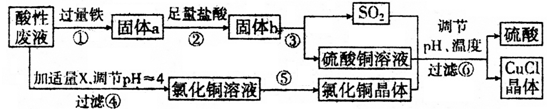
请回答下列问题:
N2(g)+3H2(g) 2NH3(g)。
①合成氨的反应中的能量变化如右图所示。该反应是反应(填“吸热”或“放热”),

②在一定条件下,将2.5mol N2和7.5mol H2的混合气体充入体积为2L的固定闭容器中发生反应:N2(g)+ 3H2(g) ⇌2NH3(g) , 5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)= ;氢气达到平衡时的转化率是: (保留小数点后一位);