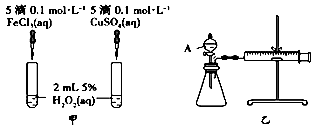
| A | B | C | D |
| | | | |
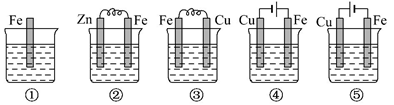
| 铜的精炼 | 铁上镀银 | 防止Fe被腐蚀 | 构成铜锌原电池 |
 B .
B . 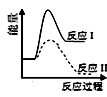 C .
C . 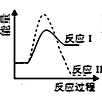 D .
D . 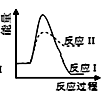
 B .
B . 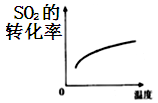 C .
C . 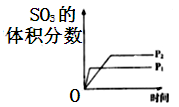 D .
D . 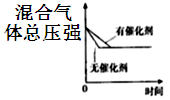
①单位时间内生成2molA的同时生成1molB ②v (B): v (C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变
| X | Y | W | |
| | 2 | 1 | 0 |
| | 1 | 0.5 | 1.5 |
①阴极、阳极所得的产物质量比为1∶8 ②通电过程中阳离子向阴极移动 ③阴极电极反应为Ag++e-=Ag ④电解过程中溶液pH升高

2C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为( )
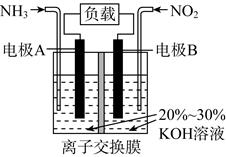
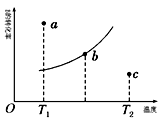
请回答下列问题:
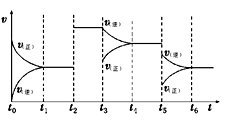
请回答下列问题:
H2(g)+1/2O2(g)=H2O(l) ΔH2
2As(s)+5/2O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =。
C(s)+
CO2(g) 2CO(g) 平衡常数K1
C(s)+ H2O(g) CO(g)+ H2(g) 平衡常数 K2
CO(g)+ H2O(g) H2(g)+ CO2(g)平衡常数K3
则K1、K2、K3之间的关系是。
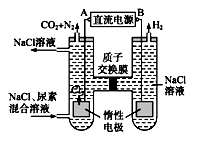
| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
请回答下列问题:
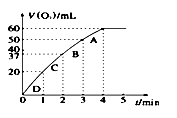
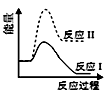
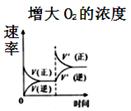
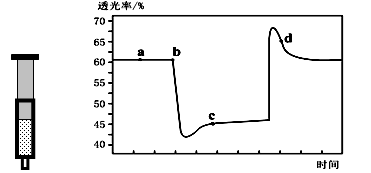
则由D到A过程中,随着反应的进行反应速率逐渐(选填 “加快”或“减慢”),其变化的原因是。
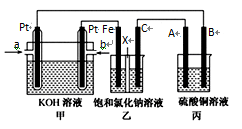
定性分析:图甲可通过观察定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是。