
已知:ClO2浓度过高时易发生分解, NaClO2高于60℃时易分解, NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出 NaClO2。
下列说法不正确的是( )

已知:气体甲是一种能使品红溶液褪色的黄绿色气体单质;固体甲是一种碱式盐,不溶于水,可溶于酸,甲中含有两种阳离子,且物质的量之比为1:3,取10.02g固体甲充分反应上理论得到铁钾矾30.18g
试设计实验检验浸取液中的主要阴离子:。
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H1=-534kJ·mol-1
1/2H2(g)+1/2F2(g)=HF(g) △H2=-269kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-484kJ·mol-1
则该条件下N2H4(g)和F2(g)反应的热化学方程式为:。
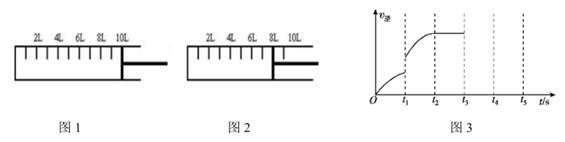
①下列表述能说明反应已达平衡的是。
A.活塞不再移动
B.容器内压强不再改变
C.容器内气体密度不再改变
D.容器内气体的平均相对分子质量不再改变
②试计算该条件下反应的平衡常数:。
③已知某次反应过程中逆反应速率随时间的变化图如图3所示。在t1时改变了某一种条件,则改变的条件可能是。
①下列说法正确的是。
A.已知该反应在较低温度下能自发进行,说明ΔS=0
B.加入催化剂,可降低反应的活化能和焓变,从而加快反应的速率
C.活化分子有效碰撞理论中,活化能指活化分子的平均能量与非活化分子平均能量的差值
D.在一定温度下,向恒容密闭容器中充入物质的量之比为1:3的NO和O3 , 达到平衡时转化率为a。
再充为入了1:3探的究NO和O3 , 转化率不变
②为了探究臭氧投加量对NO氧化脱除的影响,对一定时间内O3/NO的物质的量比值与NO脱除率进行了研究,结果如图4所示。
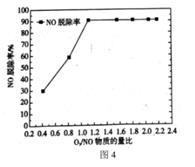
当O3/NO的物质的量比值小于1.1时,NO的脱除率随物质的量比的增大快速升高的原因可能是:。
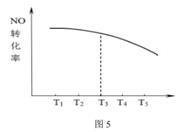
请在图5中画出不同温度下,反应都经10min,NO的转化率曲线示意图。

已知:
| 甘氨酸 (NH2CH2COOH) | 异抗坏血酸 | 甘氨酸亚铁 | FeSO4·7H2O | FeCl2·4H2O |
| 易溶于水 | 易溶于水和乙醇 | 易溶于水 | 易溶于水 | 易溶于水 |
| 微溶于乙醇 | 有弱酸性和强还原性 | 难溶于乙醇 | 难溶于乙醇 | 易溶于乙醇 |
请回答:

Ⅰ将有机氮转换为硫酸铵
Ⅱ将铵盐转化为氨气蒸出
Ⅲ用试剂吸收氨气
Ⅳ滴定
以下装置可以完成Ⅱ、Ⅲ两步操作

①将下列操作按合理顺序排入 。
仪器清洗后,在g中加入吸收剂,然后将第Ⅰ步获得的铵盐试样由d注入e→( )→( ) →( )→( )→使水蒸气进入e,蒸馏几分钟后→( )→( )→移去锥形瓶,立即用标准盐酸溶液进行滴定。
A.打开k1 B.关闭k3 , k2
C.由d注入氢氧化钠溶液,蒸馏水冲洗,并留少量液体作水封
D.加热b E.停止加热b
F.将f下端提离液面并用少量蒸馏水洗涤清洗管口
②关于滴定过程下列说法正确的是
A.滴定管必须经检漏、洗涤、润洗后才能使用
B.标准盐酸溶液裝λ滴定管后,发现下端有气泡,可将橡皮管稍冋上弯曲,挤压玻璃珠,气泡可被流水带出
C.滴定刚开始时,左手可以离开旋塞,让溶液自然流下
D.因为本测定方法较为精密和准确而操作过程繁琐,故产品纯度测定一次就可

已知:L.含碳碳双键的有机物与氨(NH3)或胺类物质(RNHR‘)反应生成新的胺类化合物
Ⅰ.R1CH-=CH2+ RNH2 R1CH2CH2NHR
Ⅱ. ![]()
Ⅲ. R1X+R2NH2→R1NHR2+HX
请回答:
请写出化合物Y下列条件的同分异构体的结构简式。
1H-NMR谱和IR谱检测表明:
①分子中有4种化学环境不同的氢原子;
②分子中只含一个环且为六元环,环中至少有一个非碳原子,环上的原子均无双键;
③分子中无羟基。
已知 ![]()
HO-CH2CH2CHO