①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成.继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成.
分析实验得出的以下结论中,正确的是( )
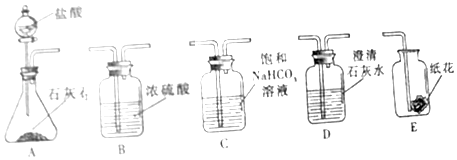
①探究二氧化碳与碱反应时,将装置A生成的二氧化碳气体通入装置D未出现浑浊,原因是;可将二氧化碳先通过装置,再通入装置D,理由是(用化学方程式表示);
②探究二氧化碳与水反应时,实验分两步进行:首先将二氧化碳通过石蕊溶液浸泡的干燥纸花,再将二氧化碳通过石蕊溶液浸泡的湿润纸花,这样做的目的是;结合上面实验,装置正确的连接顺序是(填序号)
实验步骤 | 实验现象 | 结论与解释 |
1).取一定量的食用碱样品放入试管,加入蒸馏水、振荡 | 样品溶解 | 食用碱溶于水 |
经查阅资料,铁粉在废液中发生两个化学反应:
①2FeCl3+Fe═3FeCl2②CuCl2+Fe═FeCl2+Cu
①固体沉积物质量与加入铁粉质量相等的原因是;
②经测定,反应后得到铜的质量为1.6g,其中,反应①消耗铁粉的质量是,反应②消耗铁粉的质量是(计算结果精确到0.1).