| | | | |
| A.蜡烛燃烧 | B.光合作用 | C.手机电池工作 | D.太阳能板充电 |

①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
 B .
B .  C .
C . 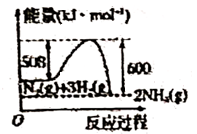 D .
D . 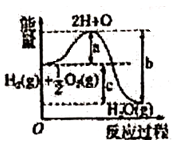

(小数点后保留一位小数)
① H2(g)+ O2(g)=H2O(l) ΔH =-285kJ/mol
② H2(g)+ O2(g)=H2O(g) ΔH =-241.8kJ/mol
③ C(s)+ O2(g)=CO(g) ΔH =-110.4 kJ/mol
④ C(s)+ O2(g)=CO2(g) ΔH =-393.5 kJ/mol
回答下列各问:
a 减压、升温 b 增压、降温
c 减压、降温 d 增压、升温