







| 实验方案 | | | | |
| 目的 | A.验证升高温度可加快H2O2分解 | B.精练铜 | C.验证AgCl沉淀 可以转变为Ag2S | D.探究浓度对化学 反应速率的影响 |

①将铜片接在电源的正极 ②将银片接在电源的正极 ③在铜片上发生的反应是:Ag+ +e-=Ag ④在银片上发生的反应是:4OH- - 4e-=O2 +2H2O ⑤可用硫酸溶液作电解质 ⑥可用硝酸银溶液作电解质

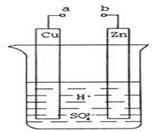
①a和b不连接时,烧杯中现象是。
②a和b用导线连接,Cu极为原电池极(填“正”或“负”),电极反应式为:;溶液中H+移向(填“Cu”或“Zn”)极。电池总反应式为:。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为g。
|
装置 |
编号 |
条件控制 |
测定结果 |
||||
|
电极材料 |
溶液浓度 |
温度/℃ |
*电解电压/V |
气体V阴:V阳 |
|||
|
阴极 |
阳极 |
||||||
|
| I | C | C | 1mol/L | 25 | 8 | >1:1 |
| II | 饱和 | 25 | 5 | ≈1:1 | |||
| III | 饱和 | 50 | 4 | ≈1:1 | |||
| IV | Fe | C | 饱和 | 50 | 3.5 | ≈1:1 | |
电解电压:开始发生电解反应时的电压


已知:BiCl3水解的离子方程式为:BiCl3+H2O ![]() BiOCl+2H++2Cl-。
BiOCl+2H++2Cl-。
①
②
③
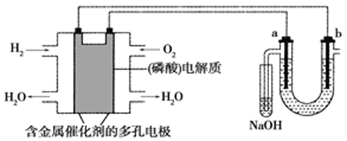
氢化过程中所需的高纯度 可用惰性电极电解
溶液制备,写出产生
的电极名称(填“阳极”或“阴极”),该电极反应方程式为。

a.B点: b.
:A点
点 c.反应适宜温度:
℃