①6和16 ②12和17 ③20和9 ④7和8.

元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、﹣3 | ﹣2 |
化学键 | H﹣H | O=O | H﹣O |
键能(KJ/mol) | 436 | 496 | 463 |
① | ② | ||||||
③ | ④ | ⑤ | ⑥ | ⑦ | |||
⑧ | ⑨ |
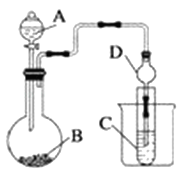
仪器A的名称为,干燥管D的作用是.
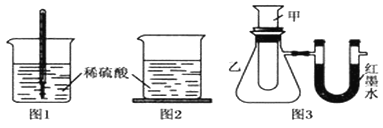
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L﹣1稀硫酸,再插入一支温度计,温度计的温度由20℃逐渐升至35℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L﹣1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
① | 氧化钙与水 | 左低右高 |
② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
③ | 铝片与烧碱溶液 | 左低右高 |
④ | 铜与浓硝酸 | 左低右高 |
根据上述实验回答相关问题: