选项 | 实验目的 | 操作 | 现象 |
A | 验证BaSO3难溶于水 | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 |
B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
C | 验证SO2的漂白性 | 将SO2通入氯水中 | 氯水褪色 |
D | 验证某化合物是钠盐 | 将该化合物在酒精灯上灼烧 | 焰色为黄色 |
①Cu与HNO3溶液
②Cu与FeCl3溶液
③Zn与H2SO4溶液
④Fe与HCl溶液.
 分离碘和酒精
B .
分离碘和酒精
B . 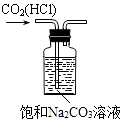 除去CO2中的HCl
C .
除去CO2中的HCl
C . 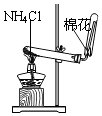 实验室制氨气
D .
实验室制氨气
D . 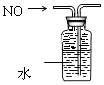 排水法收集NO
排水法收集NO
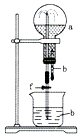
a(干燥气体) | b(液体) | |
A | NO2 | 水 |
B | CO2 | CaCl2溶液 |
C | Cl2 | 饱和NaCl溶液 |
D | NH3 | 水 |
①N2、②MgCl2、③NH4Cl、④ZnSO4、⑤CO2、⑥HClO4、⑦KOH、⑧H3PO4(填编号)
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
元素编号 | 元素性质与原子(或分子)结构 |
W | 周期表中原子半径最小的元素 |
X | 氢化物可与其最高价氧化物的水化物反应生成盐 |
Y | 一种核素在考古时常用来鉴定一些文物的年代 |
Z | M层比K层少1个电子 |
T | 存在两种同素异形体,其中一种可吸收紫外线 |

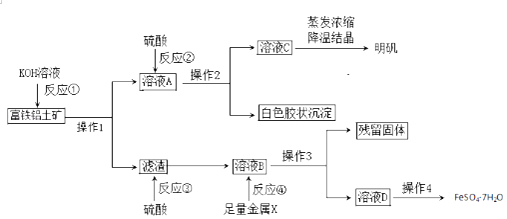
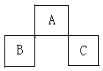
①装置A中试剂X是;装置1中反应的化学方程式是.
②实验结论:因为酸性强弱是>>(填化学式),故非金属性是S>C>Si.