 B . 液氧用于火箭发射
B . 液氧用于火箭发射  C . 石墨用作电刷
C . 石墨用作电刷  D . 干冰用于食品保鲜
D . 干冰用于食品保鲜 
 B .
B .  C .
C .  D .
D . 
 B . 开瓶器
B . 开瓶器  C .
C .  老虎钳
D . 滑轮
老虎钳
D . 滑轮 
 B . 用力搬起箱子
B . 用力搬起箱子  C . 用力推石头,但没有推动
C . 用力推石头,但没有推动 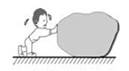 D . 举着杠铃原地不动
D . 举着杠铃原地不动 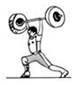
后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊。符合以上实验现象的I和Ⅱ中( )

| A | B | C | D | |
| I | CaCO3 稀HCl | Na2CO3 稀H2SO4 | Zn 稀H2SO4 | Cu 稀H2SO4 |
| Ⅱ | KNO3 | NaCl | BaCl2 | Ba(OH)2 |

| 物 质 | 选用试剂(过量) | 操作方法 | |
| A | NaOH溶液( Na2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
| B | CuSO4溶液(HCl) | 氧化铜 | 加入氧化铜粉末充分反应后过滤 |
| C | Cu(Fe) | 稀盐酸 | 加入稀盐酸充分反应后过滤、洗涤 |
| D | 盐酸(H2SO4) | 硝酸钡溶液 | 加入硝酸钡溶液充分反应后过滤 |
浅绿色滤液。关于该滤渣和滤液有下列四种说法:①向滤渣中加入稀盐酸,一定有气泡产生②向滤液中加入稀盐酸,一定有沉淀产生 ③滤渣中一定含有Ag ④滤液中一定含有
Fe(NO3)2 , 一定不含AgNO3 , 可能含有Al(NO3)3。以上说法正确的个数为( )

 B .
B .  C .
C .  D .
D . 




①酸具有相似的化学性质,但性质也存在差异。A~D图中能体现酸的通性的是;
②稀盐酸不能与氯化钡溶液反应,而稀硫酸则能与之反应生成白色沉淀,据图从微粒的角度分析写出该反应的实质是。写出一个与离子方程式Mg+2H+=Mg2++H2↑相对应的化学方程式 ;
③下列各组中的离子,能在溶液中大量共存的是。
A.K+、H+、SO42-、OH- B.Na+、H+、Cl-、CO32-
C.Na+、Ca2+、CO32-、NO3- D.Na+、Cu2+、Cl-、SO42-



请分析实验过程,回答下列问题:
|
实验次数 |
球下落的高度/m |
球的质量/g |
坑的深度/cm |
|
1 |
1 |
10 |
1.7 |
|
2 |
1 |
20 |
2.8 |
|
3 |
1 |
30 |
3.6 |
|
试管 |
A |
B |
C |
D |
E |
F |
|
CuSO4溶液/毫升 |
0 |
0.5 |
1 |
1.5 |
2 |
4 |
|
水/毫升 |
4 |
3.5 |
3 |
V1 |
V2 |
0 |
|
收集H2所用的时间/秒 |
348 |
246 |
190 |
165 |
230 |
360 |

硫酸,按上表所示条件进行实验,并测量收集50毫升氢气所用的时间。试管D中加入水的体积V1= 毫升。由上表可得出,CuSO4溶液的量对稀硫酸与锌反应速率影响的变化的趋势是。小明发现当硫酸铜溶液质量大于1.5毫升,产生氢气的速率反而降低,联想到与实验室制取二氧化碳不能用石灰石和稀硫酸原理相似,原因是 。

|
小球 |
质量/克 |
高度/厘米 |
木块移动距离/厘米 |
|
A |
10 |
5 |
10 |
|
B |
20 |
5 |
18 |
|
C |
30 |
5 |
29 |
|
D |
10 |
10 |
38 |
|
E |
10 |
15 |
86 |
请根据上表数据分析,货车超载20%与超速20%两者相比,潜在危害较大是。
实验一:取5枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验。
|
实验图示 |
| | | | |
| 生锈时间 | 8分钟 | 较长时间不生锈 | 5分钟 | 3分钟 | 1分钟 |
实验二:为探究铁锈的成分,用如图所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全)。

实验记录:
|
铁锈样品的质量/g |
装置B的质量/g |
装置C的质量/g |
|
|
反应前 |
23.2 |
232.4 |
198.2 |
|
反应后 |
239.6 |
211.4 |

请利用弹簧测力计写出直接否定这一结论的主要实验步骤:
①将刻度尺平放在支座上,左右移动刻度尺,找出能够使刻度尺在水平位置保持平衡的支点位置,记下这个位置,它就是刻度尺的重心。
②如图6所示,将质量为M1的物体挂在刻度尺左边某一位置,使刻度尺能够在支座上重新保持水平平衡。记录物体悬挂点到支座的距离L1和刻度尺的重心到支座的距离L2;
③根据杠杆的平衡条件,可以计算出刻度尺的质量m=(用题目中所给物理量表示)。


步骤一:配制溶质质量分数为10%的氢氧化钠溶液。
步骤二:向20克待测稀盐酸中逐渐滴入上述氢氧化钠溶液,并使用pH计记录溶液的pH变化情况,绘制图像。

|
材料 |
锰钢 |
铝合金 |
钛合金 |
碳纤维 |
|
性能(强度) |
强 |
较弱 |
较强 |
强 |
|
密度/kg•m﹣1 |
7.9×103 |
3.0×103 |
4.5×103 |
1.6×103 |
|
实验编号 |
所需合格样品的质量/g |
所取稀硫酸的质量/g |
生成氢气的质量/g |
|
1 |
10.0 |
40.0 |
0.1 |
|
2 |
10.0 |
50.0 |
0.1 |
|
3 |
20.0 |
36.5 |
0.1 |
的质量与稀硫酸的质量之比为


|
Na2CO3溶液质量/g |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
沉淀质量/g |
0 |
1 |
n |
3 |
4 |
5 |
m |
①求m值。(写出计算过程)
②加入10gNa2CO3溶液时发生反应的化学方程式是 ▲ 。