①电灯通电发光②煤制成焦炭③塑料老化④干冰升华⑤石油分馏⑥海水制镁⑦石块粉碎成石子⑧粮食酿酒.
 制备和检验氢气的可燃性
B .
制备和检验氢气的可燃性
B .  向试管中倾倒液体试剂
C .
向试管中倾倒液体试剂
C .  蒸发食盐水
D .
蒸发食盐水
D .  测定溶液的pH
测定溶液的pH

食物 | 白葡萄汁 | 苹果 | 牛奶 | 玉米粥 |
pH | 3.5﹣4.5 | 2.9﹣3.3 | 6.3﹣6.6 | 6.8﹣8.0 |


选项 | 物质(括号内为杂质) | 除去杂质的方法 |
A | MnO2(KCl) | 加水溶解、过滤、洗涤、干燥 |
B | CaO(CaCO3) | 高温煅烧至固体质量不再改变 |
C | N2(O2) | 通过灼热的足量的铜网 |
D | NaOH溶液(Na2CO3) | 滴加适量氯化钙溶液,过滤 |
 足量的铁片和镁条分别与等质量、等质量分数的稀盐酸反应
B .
足量的铁片和镁条分别与等质量、等质量分数的稀盐酸反应
B .  将浓盐酸敞口放置在空气中
C .
将浓盐酸敞口放置在空气中
C . 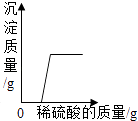 向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
D .
向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
D .  向pH=2的盐酸溶液中加水稀释
向pH=2的盐酸溶液中加水稀释
①陶瓷杯②黄沙③羊毛衫④煤炭⑥玻璃茶壶⑥塑料盆⑦酒精.
生活中,常会接触到下列物质:A.铜丝 B.天然气 C.干冰 D.食盐水
其中属于混合物的是(填字母,下同),属于氧化物的是.
实验编号 | 1.探究人体呼出气体中二氧化碳含量比空气中的高 | 2、探究影响品红扩散快慢的因素 | 3、探究硫在空气和氧气中燃烧 |
实验设计 |
|
|
|
实验分析 | 本实验条件除了要控制两个盛装气体样品的集气瓶大小规格相同外,还要控制相同. | 发现两杯水都变红,且整杯热水变红时间比冷水要短,由此说明:①分子在不断运动;②影响分子运动快慢的因素有. | 取等量的硫粉点燃后,分别插入相同规格的盛有空气和氧气样品的集气瓶中,发现硫在氧气中燃烧更剧烈,该对比实验所得结论为. |
①下列表述正确的是.
A.蜡烛燃烧后质量减少,说明质量守恒定律不是普遍规律
B.每32gS和32gO2完全反应后,生成64gSO2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②物质X是一种可再生绿色能源,其燃烧的化学方程式为X+3O2 2CO2+3H2O,则X的化学式为.
a.酸雨 b.温室效应 c.可吸入颗粒物增加
①尿素[CO(NH2)2]属于化学肥料中的肥.
②生产甲醇(CH3OH).
“捕捉”CO2:在高压时将烟道气中的CO2溶解于甲醇,得到CO2的甲醇溶液.所得溶液中溶质是.
用“捕捉”CO2生产甲醇,反应的微观示意图如下:

该反应的化学方程式为.
③还可以利用NaOH溶液来“捕捉”CO2 , 并将CO2储存或利用,流程如下:

下列有关该过程的叙述正确的有.
a.该过程可实现CO2零排放
b.该过程中至少有2种物质可以循环利用
C.反应分离室中分离物质的操作是蒸发、结晶
d.该过程中至少发生了4个化学反应.

①写出Na2SO4与BaCl2反应的化学方程式:;
②把易溶于水、易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示.上述方程式可改写成:2Na++SO42﹣+Ba2++2Cl﹣═BaSO4↓+2Na++2Cl﹣
③删去方程式两边不参加反应的离子:Ba2++SO42﹣═BaSO4↓
④检查方程式两边各元素的原子个数和电荷总数是否相等.

①生成CO2反应的化学方程式.
②F装置的作用是.
③H装置中的现象可说明CO2具有的性质是(答一点即可).
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的碳酸钠溶液,依次测量溶液的pH,记录数据如下表:
实验编号 | a1 | a2 | a3 | b1 | b2 | b3 | c1 | c2 | c3 |
溶质质量分数 | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
水的温度(℃) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 40 | 70 |
溶液pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | 11.46 | 11.50 |
请你分析表中数据回答:
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 |
溶液pH | 11.22 | 11.35 | 11.46 | 11.48 | 11.50 | 11.50 |
①当温度介于20℃~40℃时,温度对碳酸钠溶液的pH影响比较(选填“大”或“小”).
②小菁将适量碳酸钠粉末洒在沾有油污的餐具上,并冲入适量的热水,再进行擦洗,达到较好的洗涤效果,这是因为.
a.酚酞试液 b.稀盐酸 c.氯化钠溶液 d.氯化钙溶液
滴加氢氧化钡溶液的质量/g | 5 | 10 | 25 | 30 |
烧杯中产生沉淀的质量/g | 1.165 | 2.33 | 4.66 | 4.66 |

求: