 B .
B .  C .
C .  D .
D . 
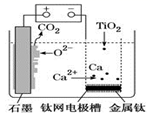

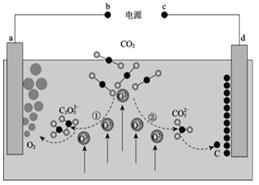
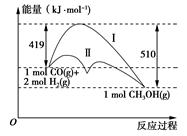
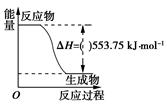
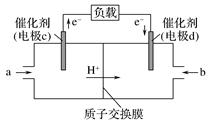
①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是(填“正极”或“负极”),c电极的反应方程式为。
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH=(不考虑溶液体积变化)。
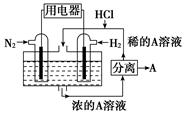
|
实验 编号 |
实验目的 |
T/K |
催化剂 |
浓度 |
|
甲组 实验Ⅰ |
作实验 参照 |
298 |
3滴FeCl3 溶液 |
10 mL 2% H2O2 |
|
甲组 实验Ⅱ |
① |
298 |
② |
10 mL 5% H2O2 |
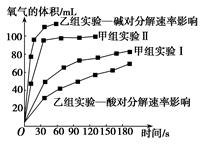
①由甲组实验数据可得出文字结论。
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析:相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是;乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2 , 其化学反应方程式为;支持这一方案的理由是。
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1 173 K | 2.15 | 1.67 |
请填空:

①图甲中t2时刻发生改变的条件是。
②图乙中t2时刻发生改变的条件是。
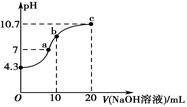
①写出H2N2O2在水溶液中的电离方程式:。
②c点时溶液中各离子浓度由大到小的顺序为。
③b点时溶液中c(H2N2O2) c(N2O22-)。(填“>”“<”或“=”,下同)
④a点时溶液中c(Na+)c(HN2O)+c(N2O22-)。
|
实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
|
c(HA) |
c(KOH) |
||
|
① |
0.1 |
0.1 |
9 |
|
② |
x |
0.2 |
7 |