

①将铁块换为等质量的铁粉; ②加入少量NaNO3固体; ③加入少量CuSO4固体;
④加入少量CH3COONa固体; ⑤加热; ⑥将稀硫酸换成98%硫酸。
其中可以加快氢气的生成速率的措施是( )



以O2浓度变化表示的反应速率,0~4s内的(填“小于”、“大于”或“等于”)1~5s内的。
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.v逆(NO)=2v正(O2) D.气体密度保持不变

已知:①经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
②SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③SrCl2·6H2O的摩尔质量为:267 g·mol-1。
①滴定反应达到终点的现象是。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为(保留4位有效数字)。
N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。则相同条件下破坏1 mol NO中的化学键需要吸收的能量为kJ。

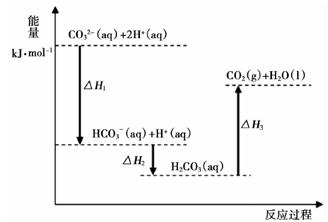
①在同一溶液中,H2CO3、HCO3-、CO32-(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的微粒主要为。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh=。
将SO2通入水中形成“SO2-饱和H2SO3溶液”体系,此体系中存在多个含硫元素的平衡,写出其中1个平衡方程式:。
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图1的实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:。
如图2是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。

关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是。
用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入图3装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。M极发生的电极反应式为。
