体液 | 血浆 | 胃液 | 胆汁 | 胰液 |
pH | 7.35~7.45 | 0.9~1.5 | 7.1~7.3 | 7.5~8.0 |

从均衡营养的角度看,你认为他们的午餐中缺乏的营养素是.高钙饼干中的“钙”指的是.
淀粉在人体内的消化过程为:
 .X的化学式为.
.X的化学式为.
序号 | 项目 | 检测结果(mg/L) | 评价 |
① | 悬浮物 | 80 | ↑ |
② | pH | 6.8 | 正常 |
③ | 总氮(以N计) | 40 | ↑ |
④ | 总磷(以P计) | 8 | ↑ |
⑤ | 粪大肠菌群数/(个•L﹣1) | 103 | ↑ |
①根据检测结果可知该水库水草疯长的原因是.
②根据检测结果,小组同学设计如下净水方案:
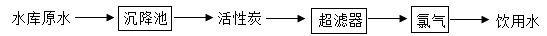
该方案中氯气的作用是.除上述方案采用的净水措施外,还可以采用方法净化水.
a、氢能 b、石油 c、风能 d、煤炭
①取少量硫酸铜溶液于试管A中,将铁片(足量)插入硫酸铜溶液中,充分反应后将铁片取出,观察到的实验现象是.
②(请补充实验具体操作).
③取少量硫酸铜溶液于试管B中,将铝片插入硫酸铜溶液中,充分反应,写出该反应的化学方程式.
结论:三种金属的活泼性由强到弱顺序是.
a、齿轮表面涂油 b、将钢材深埋保存
c、将钢刀浸泡在盐水中 d、车圈镀铬.
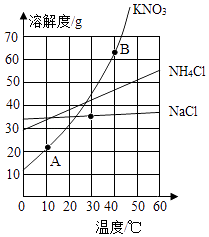
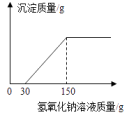
①三种固体物质的溶解度受温度影响最小的是.
②30℃时三种固体物质饱和水溶液中溶质的质量分数由大到小的顺序是.
③图中A、B点的坐标为:A(10,21)、B(40,64).若将100g40℃的硝酸钾饱和水溶液降温到10℃,析出KNO3固体的质量为g(保留一位小数).
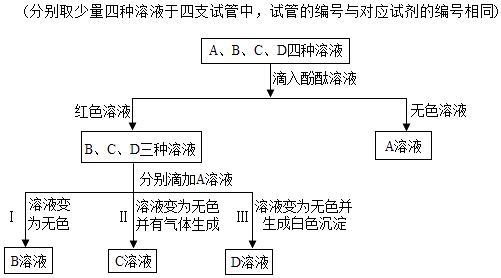
①写出反应Ⅲ的化学方程式.
②如图是水和NaOH水溶液中微粒的存在情况示意图,由此分析C溶液能使酚酞溶液变红的原因是(填序号).

a.C溶液中Na+数目大于CO32﹣数目
b.C溶液中H2O数目大于OH﹣数目
c.C溶液中H2O数目大于H+数目
d.C溶液中OH﹣数目大于H+数目.


a.该操作中用到的玻璃仪器有酒精灯、玻璃棒、蒸发皿
b.该操作中用玻璃棒不断搅拌的目的是防止局部温度过高,造成液滴飞溅
c.当蒸发皿中出现较多固体时,停止加热
d.停止加热后,立即将蒸发皿直接放在试验台上.
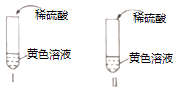
收集资料
①上述三种氧化物在加热条件下,都能与氢气反应得到相应的金属单质和水.
②三种氧化物中氧元素的质量分数由大到小的顺序为.
③铁粉中混有少量铜时,难以从金属颜色确定是否含有金属铜.
设计方案进行实验
乙组同学用如下图装置进行实验(碱石灰是氧化钙与氢氧化钠固体混合物). 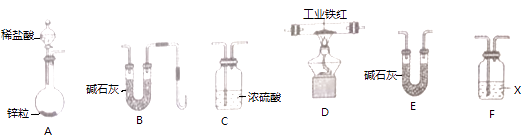
①乙组同学的实验装置中,依次连接的合理顺序为A→F→→→→B,检查装置气密性后,向各装置中加入药品,装置F中试剂X是溶液,装置C的作用是.
②下列实验操作步骤的合理顺序是(填写操作编号).
a.加热装置D中反应管 b.检验H2的纯度
c.打开装置A中分液漏斗活塞,向圆底烧瓶中加入稀盐酸
③该实验处理尾气的方法是.
实验分析与结论
乙组同学的两次实验数据如表:(两次实验工业铁红均与氢气完全反应)
实验编号 | 加入装置D中工业铁红的质量(g) | 实验后装置E的增重(g) |
① | 8.0 | 2.6 |
② | 16.0 | 5.2 |
①分析数据,你的实验结论是.
②请帮助乙组同学设计实验方案确认该样品中杂质的成分.
(写出操作、现象和结论,若该样品中不含杂质本题不必作答)
实验序号 | 所取样品质量(g) | 所加盐酸质量(g) | 生成氢气质量(g) |
Ⅰ | 16.0 | 60.0 | 0.5 |
Ⅱ | 16.0 | 130.0 | 1.0 |
Ⅲ | 16.0 | 150.0 | 1.0 |
镁粉样品中金属镁的质量百分含量为.