| 选项 | 实验事实 | 理论解释 |
| A | 酸性:HClO<H2CO3 | 非金属:C>Cl |
| B | NH3溶于水形成的溶液能导电 | NH3是电解质 |
| C | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| D | H2O的沸点高于H2S | H-O的键能大于H-S的键能 |
| 选项 | 实验目的 | 实验设计 |
| A | 检验溶液中是否含有Fe2+ | 取少量溶液,滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 |
| B | 检验丙烯醛中是否含碳碳双键 | 向丙烯醛溶液中滴加KMnO4(H+) |
| C | 比较AgBr和AgCl的Ksp大小 | 向AgCl的饱和溶液的滴加NaBr |
| D | 比较水与乙醇中羟基氢的活泼性 | 分别将少量钠投入盛有水和乙醇的烧杯中 |



| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
下列说法正确的是( )

已知:转化过程中的反应为2CrO (aq) +2H+(aq)
Cr2O
(aq)+H2O(I)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )




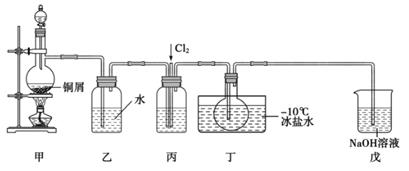
(已知:NO+NO2+2NaOH=2NaNO2+H2O)



①过程Ⅰ~Ⅲ中碳元素发生反应(填“氧化”或“还原”)。
②请补充完整并配平CO2转化为LDPE的电极反应:2nCO2+ + =[H2C-CH2]n+ 。
③工业上生产1.4×104g的LDPE,理论上需要标准状况下CO2的体积是L。


根据上图分析:沉钴时应控制n(C2O ):n(Co2+)比为,温度控制在℃左右。

已知:

请按要求回答下列问题