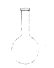 蒸馏烧瓶
B .
蒸馏烧瓶
B .
| 强电解质 | 弱电解质 | 非电解质 |
A | 钠 | 碳酸 | 氨气 |
B | 氯化钠 | 水 | Cu |
C | 硫酸钡 | 氢氧化钙 | 硅酸 |
D | 烧碱 | 次氯酸 | CO2 |

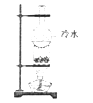
①第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
②第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
③在②的滤液中滴入AgNO3 , 产生白色沉淀,加稀硝酸,沉淀不溶解.
下列说法正确的是( )
3SiO2+6C+2N2 Q+6CO
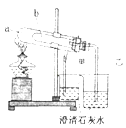
a.需称量CuSO4•5H2O晶体2.5g
b.将固体溶解、冷却后,依照如图转移至容量瓶

c.需用蒸馏水洗涤烧杯和玻璃棒2﹣3次,洗涤液均转入容量瓶
d.定容摇匀后,发现液面低于刻度线,继续向容量瓶中加水至凹液面与刻度相切即可
①容量瓶内壁附有水珠而未干燥,
②在定容时,俯视刻度线.