①C(s)+O2(g)═CO2(g);△H1 C(s)+ O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8 .
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H1、△H2、△H3间的关系正确的是( )
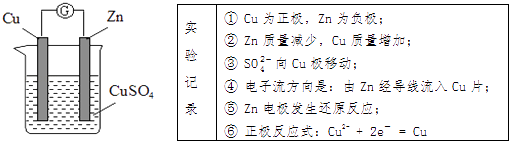

 用如图装置电解精炼镁
B .
用如图装置电解精炼镁
B .  用如图装置验证试管中铁丝发生析氢腐蚀
C .
用如图装置验证试管中铁丝发生析氢腐蚀
C .  如图装置中Mg作负极,Al作正极
D .
如图装置中Mg作负极,Al作正极
D .  用如图装置对二次电池进行充电
用如图装置对二次电池进行充电
试管 | 温度 | 过氧化氢浓度 | 催化剂 |
A | 室温(25℃) | 12% | 有 |
B | 水浴加热(50℃) | 4% | 无 |
C | 水浴加热( 50℃) | 12% | 有 |
D | 室温(25℃) | 4% | 无 |
②H2(g)+ O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
③C(s)+ O2(g)=CO(g)△H=﹣110.5kJ•mol﹣1
④C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1 ,
回答下列问题:
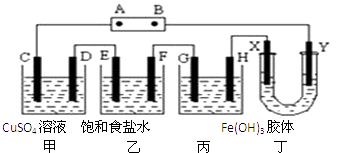
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于处.
②若X为锌,开关K置于M处,该电化学防护法称为.


实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.4 |
2 | 20.2 | 20.4 | 23.6 |
3 | 20.5 | 20.6 | 23.8 |
依据该学生的实验数据计算,该实验测得的中和热△H为.(保留三位有效数字)


①同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:;
②熔化的KClO3放出气泡很慢,加入少量MnO2很快产生气体:.
①升高温度,反应速率;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率.