 B .
B . 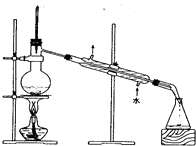 C .
C . 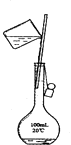 D .
D . 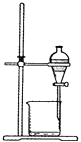
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 铝具有强还原性 | 可用铝与浓硫酸反应制备氢气 |
B | Fe(OH)2稳定 | 用FeCl2溶液和NaOH溶液反应可制取纯净的Fe(OH)2 |
C | Na2O2与CO2反应生成氧气 | Na2O2可作供氧剂 |
D | 二氧化硅不与任何酸反应 | 可用二氧化硅制造耐酸容器 |
在常温下能导电的是,属于电解质的是.
硅可用于制作电池;漂白液的有效成分是(填化学式);铝和烧碱溶液反应的离子方程式是;区别浓硫酸和稀硫酸的简单方法是(列举一种方法).
⑴取少量混合物,加水,得到无色透明溶液;
⑵向⑴中溶液加过量BaCl2溶液,有白色沉淀生成,过滤,分别对沉淀和滤液进行下列实验;
⑶向上述白色沉淀中加足量稀盐酸,沉淀部分溶解,并产生气体;
⑷向上述滤液中加AgNO3溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解.
根据以上实验现象判断,混合物中肯定有(填化学式,下同);肯定没有;可能有.
配制FeI2溶液除烧杯、量筒、胶头滴管外,还需要的玻璃仪器是.
取10mL上述FeI2溶液,向其中滴加少量新制的氯水,振荡后发现溶液呈黄色.同学们对产生黄色的原因提出假设:
假设1:只有I﹣被少量Cl2氧化成I2溶解在溶液中,还原性:I﹣>Fe2+;
假设2:只有Fe2+被少量Cl2氧化成Fe3+ , 还原性:Fe2+>I﹣ .
设计方案,验证假设
实验方案 | 预期现象 | 结论 |
假设1正确 | ||
假设2正确 |
假设转化过程的损失可以忽略不计,计算该电厂每天用“钙基固硫法”处理产生的SO2 , 可获得纯度为85%的CaSO4多少吨?