 B .
B .  C .
C .  D .
D . 
①将工业冷却水进行循环利用 ②用未经处理的工业废水灌溉农田 ③利用太阳能、离子交换树脂、半透膜等技术,使海水淡化
④用喷淋节水龙头代替用水较多的旧式龙头 ⑤用大量的水冲洗汽车代替人工擦洗.
将燃着的镁条伸入盛有二氧化碳的集气瓶中,镁条继续燃烧,反应的化学方程式为2Mg+CO2 2MgO+C,下列有关叙述错误的是( )
2MgO+C,下列有关叙述错误的是( )
下列实验方案及现象与结论一致的是( )
项目 | A | B | C | D |
方案 |
|
|
|
|
现象 | 蜡烛由低到高依次熄灭 | 干冷烧杯内壁出现无色液滴,澄清石灰水变浑浊 | 振荡后,塑料瓶变瘪 | 水中的铁钉生锈,植物油中的铁钉没生锈 |
结论 | 一般情况下,二氧化碳不燃烧也不支持燃烧,密度比空气大 | 气体中一定有碳、氢元素、氧元素 | 二氧化碳能溶于水也能和水发生反应 | 铁生锈只需要与氧气接触 |
矿物质水中主要成分(mg/1L) | |
偏硅酸(H2SiO3)≥25 | 钙≥0.2 |
硫酸根≥0.05 | 钠≥0.2 |
氯离子≤5 | 镁≥0.2 |
①矿泉水中含有的镁元素;
②久置的水中溶有一定量的氧气,请表示出n个氧分子;
③表中的一种阴离子等;
④硫酸钙中钙元素的化合价.
脱氧剂 | 洁厕灵 | 炉灶清洁剂 | |
有效成分 | 还原铁粉 | 盐酸 | 氢氧化钠(分解油污,有强烈的腐蚀性) |
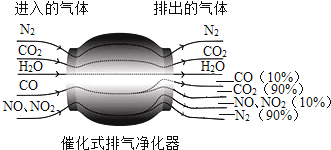
根据如图所提供的信息,写出在催化式排气净化器中发生的一个反应(用化学方程式表示).
隔绝空气进行“焙烧”,铁元素的转化途径是 ![]() FeO
FeO![]() ,实际作还原剂的是CO,写出“焙烧”过程中各反应的化学方程式: a.FeCO3
,实际作还原剂的是CO,写出“焙烧”过程中各反应的化学方程式: a.FeCO3![]() FeO+CO2↑b. CO2+C
FeO+CO2↑b. CO2+C![]() 2CO ;该反应为(吸热或放热)c. FeO+CO
2CO ;该反应为(吸热或放热)c. FeO+CO![]() .
.
实验一 | 实验二 |
| 2 |
【活动与探究一】用对比实验方法探究二氧化碳的性质.
实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为;对比A瓶与(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
实验三 | 实验四 |
|
|
实验三目的是探究对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和.
【活动与探究三】定量测定空气中氧气的含量.
实验五


实验五中,反应的原理为(用化学方程式表示);装置一比装置二更合理,理由是;
根据下表提供的实验数据,完成下表:
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
30mL | 20mL | 12mL |
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果(填“偏小”、“偏大”或“无影响”).
【应用研究】
【制备研究】
将金属钠与液态氨反应得NaNH2 , 再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O═NaN3+NaOH+X,X气体的化学式.
【Na2CO3质量分数测定】
工业级NaN3中常含有少量的Na2CO3 , 为测定样品中Na2CO3的质量分数设计如图1装置.
(已知H2SO4溶液与NaN3 , 反应不生成气体.与碳酸钠反应生成二氧化碳气体).
提示:碱石灰是NaOH和CaO固体,能吸水和二氧化碳气体,氢氧化钠与二氧化碳反应生成碳酸和水.
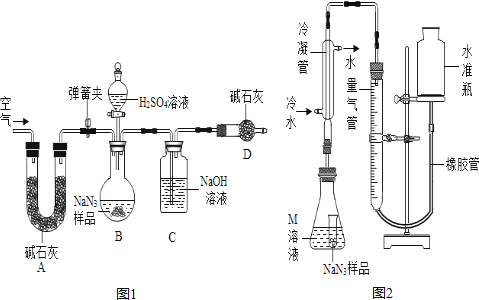
①精确称量样品,检查装置气密性;
②打开弹簧夹,鼓入空气,称量装置C;
③关闭弹簧夹,打开分液漏斗活塞;
④再打开弹簧夹,鼓入空气;此次鼓入空气的作用是.
⑤再次称量装置C.计算碳酸钠含量至少需要测定(填数字)个数据.如不用装置C后的球型干燥管装置,则得到的碳酸钠的含量(填“偏小”、“偏大”或“无影响”).
【NaN3纯度测定】
精确称量0.140gNaN3样品,设计如图2装置,测定其纯度.已知2NaN3→3N2(NaN3中的N全部转化为N2 , 其他产物略),反应中放出大量的热.