 B . 洗气
B . 洗气  C . 溶解
C . 溶解  D . 蒸发
D . 蒸发 
 B . 水分子的结构式:
B . 水分子的结构式: 

 装置用于实验室制备氯气
B .
装置用于实验室制备氯气
B .  装置实验室制氨气
C .
装置实验室制氨气
C . 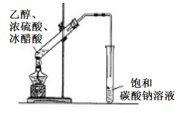 装置用于实验室制乙酸乙酯
D .
装置用于实验室制乙酸乙酯
D .  装置可进行碳酸氢钠受热分解
装置可进行碳酸氢钠受热分解
| 容器 | 起始时 | 平衡时HCl转化率 | |||
| n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
| 甲 | 0.8 | a | 96% | 94% | 90% |
| 乙 | 0.8 | b | 46% | 44% | 40% |
| 丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是( )


下列说法不正确的是( )
| 温度/ | 30 | 35 | 40 | 45 | 50 |
| TiO2 ·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |

下列有关推断合理的是( )


请回答下列问题:


①在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均末失效),写出300℃之后脱氮率减小的原因是。
②其他条件相同时,请在图中补充在催化剂B作用下脱氮率随温度变化的曲线。

①x的取值范围为。
②反应后溶液中n(NO2-)︰n(NO3-)=。(用含x的代数式表示)

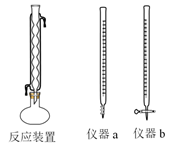
操作步骤:
Ⅰ量取20.00mL水样于圆底烧瓶中,并加入数粒碎瓷片;Ⅱ量取10.00mL重铬酸钾标准溶液中加入到圆底烧瓶中,安装反应装置(如上图所示)。从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应后停止加热。Ⅲ待反应液冷却后加入指示剂2滴,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。发生的化学反应方程式为Cr2O72-+14H++6Fe2+=6Fe3++2Cr3++7H2O。请回答:
①量取10.00mL重铬酸钾标准溶液用到的仪器是(填仪器a或仪器b)。
②下列有关说法正确的是 (用相应编号填写)。
A.配制重铬酸钾标准溶液时所有需用到仪器有:天平(含砝码)、玻璃棒、烧杯和容量瓶
B.滴定前锥形瓶、滴定管均需用蒸馏水洗后再用待取液进行润洗
C.滴定时用左手控制旋塞,眼睛注视锥形瓶内液体颜色变化,右手摇动锥形瓶,使溶液向同一方向旋转
D.加热回流结束后,未用蒸馏水冲洗冷凝管管壁,则滴定测得的硫酸亚铁铵体积偏小
③已知:重铬酸钾标准溶液的c(Cr2O72-)=0.02000mol·L-1 , 硫酸亚铁铵溶液的c(Fe2+)=0.01000 mol·L-1 , 滴定终点时所消耗的硫酸亚铁铵溶液的体积为18.00mL,则按上述实验方法,测得的该水样的化学需氧量COD=mg/L。

①由图1、图2可知下列推论不合理的是。
A.活性炭对污水中的还原性物质具有一定的吸附作用
B.酸性条件下,铁屑和活性炭会在溶液中形成微电池,铁为负极,溶液中有大量的Fe2+、Fe3+
C.当铁碳混合物中铁的体积分数大于50%时,COD的去除率随着铁的质量分数增加而下降的主要原因是溶液中微电池数目减少
D.工业降低污水COD的最佳条件为:铁的体积分数占50%;污水溶液pH约为3
②根据图2分析,COD的脱除率降低的原因可能为。
①与NaHCO3溶液反应,0.1mol该同分异构体能产生4.48L(标准状况下)CO2气体;②苯环上的一氯代物只有两种且苯环上的取代基不超过三个;③核磁共振氢谱有五种不同化学环境的氢,且峰面积比为1:2:2:2:3。