| 选项 | 目的 | 实验 |
| A | 除去溴苯中的溴 | 加蒸馏水后振荡、分液 |
| B | 验证SO2的漂白性 | 将SO2通入高锰酸钾溶液中 |
| C | 区分葡萄糖溶液和淀粉溶液 | 往两溶液中分别滴加KI溶液 |
| D | 比较浓H2SO4与浓HNO3的氧化性的强弱 | 常温下,将铜丝分别插入两溶液中 |
 )是合成橡胶的主要原料。下列说法正确的是( )
)是合成橡胶的主要原料。下列说法正确的是( )




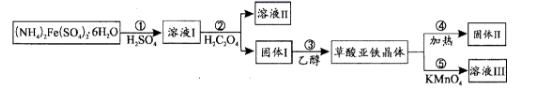
已知:常温下,pH>4时,Fe2+容易被氧化;H2C2O4的Ka1=5.9×10-2 , Ka2=6.5×10-5;Ksp(FeC2O4•xH2O)=3.2×10-7
回答下列问题:


反应i:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.01kJ•mol-1
反应ii:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H=-165.0kJ•mol-1
反应iii:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.17kJ•mol-1
回答下列问题:
历程I:

历程II:

历程III:

①历程1方框内反应的方程式为CO2*+*=CO*+O*(*为催化剂活性位点)。根据图示,其反应热△H0(填“>”或“<”)。
②反应历程II方框内的方程式是。
③反应历程中(填“历程I”、“历程II”或“历程III”)是RWGS的控速步骤。

①1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是、。M点平衡组成含虽高于N点的原因是。
②当CH4和CO平衡组成为40%时,该温度下反应iii的平衡常数Kp为。
A.  B.
B. 
C.  D.
D. 
|
CH4 |
SiH4 |
GeH4 |
|
|
沸点/℃ |
-161.5 |
-119 |
-88.1 |


 制备的
制备的  合成路线(无机试剂任选)。
合成路线(无机试剂任选)。