 C . 原子核内有10个中子的氧原子:
C . 原子核内有10个中子的氧原子: ①稀豆浆、硅酸、氯化铁溶液都属于胶体
②氯水、次氯酸都属于弱电解质
③Na2O、MgO、Al2O3均属于碱性氧化物
④明矾、冰水混合物、四氧化三铁都不是混合物
⑤电解熔融的Al2O3、12C 转化为14C 都属于化学变化
⑥葡萄糖、油脂都不属于有机高分子
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | Mg(Al) | NaOH溶液 | 过滤 |
| B | 乙烷(乙烯) | 溴水 | 洗气 |
| C | CuCl2(FeCl3) | 单质铜 | 过滤 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |

![]()

 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B .
图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B .  图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)
图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)  图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D .
图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D .  图丁表示分别稀释10 mL pH均为12的NaOH和NH3⋅H2O溶液时pH的变化,曲线I表示NH3⋅H2O溶液,n>100
图丁表示分别稀释10 mL pH均为12的NaOH和NH3⋅H2O溶液时pH的变化,曲线I表示NH3⋅H2O溶液,n>100
 芥子醇分子中所有碳原子可能在同一平面内,且与足量浓溴水反应最多消耗1molBr2
芥子醇分子中所有碳原子可能在同一平面内,且与足量浓溴水反应最多消耗1molBr2


A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度

A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有。
甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是,由此可知分解产物中有(填化学式)。
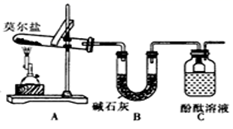
D. 品红溶液  E.NaOH溶液
E.NaOH溶液  F.BaCl2溶液和足量盐酸
F.BaCl2溶液和足量盐酸  G.排水集气法
G.排水集气法  H. 安全瓶
H. 安全瓶 ![]()
①乙同学的实验中,装置依次连按的合理顺序为:A→H→() →() →() →G。
②证明含有SO3的实验现象是;安全瓶H的作用是。
甲方案:取25.00mL样品溶液用0.1000mol/L的酸性K2Cr2O7溶液分三次进行滴定。
乙方案(通过NH4+测定):实验设计装置如图所示。取25.00mL样品溶液进行该实验。
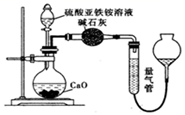
请回答:
甲方案中的离子方程式为。
a.水 b.饱和NaHCO3溶液 c.CCl4 d.饱和NaCl溶液

①用Ir和Ce作催化剂时,反应的活化能更低的是;
②a、b、c、d和e五种状态,反应一定达到平衡状态的是,反应的ΔH 0(填“>”、“=”或“<”);
③从状态a到c,CO2转化率不断增大的原因是;
④已知T℃下,将2 molCO2和6 molH2通入到体积为V L的密闭容器中进行上述反应,反应时间与容器内的总压强数据如表:
| 时间t/min | 0 | 10 | 20 | 30 | 40 |
| 总压强p/1000kPa | 1.0 | 0.83 | 0.68 | 0.60 | 0.60 |
该反应平衡时CO2的转化率为。