 的名称为 2,3,3-三甲基丁烷
的名称为 2,3,3-三甲基丁烷
 和
和  均可以通过缩聚反应制取
均可以通过缩聚反应制取
C6H12 (g) C6H6 (g)+3H2(g)。一定条件下,下图装置可实现有机物的电化学储氢:

下列说法不正确的是( )
|
编号 |
平衡方程式 |
平衡常数 |
|
① |
HCN |
Ka= 1×10 -10 |
|
② |
H2O |
Kw=1×10 -14 |
|
③ |
CN-+H2O |
K =? |
则下列判断错误的是( )

已知:在室温下,HNO2和 CH3COOH 的电离常数分别为5.0×10 -4 和 1.7×10 -5
下列说法正确的是( )
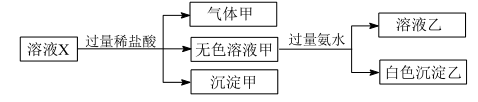
下列判断正确的是( )
已知:在室温下,Ksp(AgBr)=5.4×10 -13 , Ksp(AgCl)=1.8×10 -10
向 BaCl2溶液中加入 AgNO3和 KBr,当两种沉淀刚好共存时,溶液中 = 。
写出简要计算过程:

请回答下列问题:
工业上冶炼单质 2 的化学方程式为
NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式

已知①SiHCl3 沸点 33.0℃,上述反应在 1000~1100℃进行;
②SiHCl3 能与 H2O 强烈反应,在空气中易自燃。请回答下列问题:
下列说法不正确的是

①反应Ⅰ:2H2SO4(l) =2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ•mol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJ•mol -1
反应Ⅱ的热化学方程式为 。
②对于反应Ⅱ,将投料比【n(SO2):n(H2O)】为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图 1 所示。下列说法不正确的是

图 1
A.p2>p 1 , 反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比【n(SO2):n(H2O)】改变为 2:1,可提高 SO2 的平衡转化率
D. 当容器内气体的密度不变时,可判断反应达到平衡状态
E. 温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2 , 达到第 2 次平衡后再次分离H2 , 重复多次,平衡时 n(HI)如下表:
|
达到平衡的次数 |
第 1 次 |
第 2 次 |
第 3 次 |
第 4 次 |
第 5 次 |
…… |
|
n(HI)/mol |
0.78 |
0.67 |
0.60 |
0.55 |
0.51 |
…… |
归纳出分离 H2 的次数对 HI 转化率的影响。第 2 次平衡时 I2 的物质的量为 n(I2)=mol


已知:①锂电池废料的主要成分是 LiCoO2、铝、炭黑及其他杂质。
②“溶液 A”中主要金属离子是 Co2+、Li+ , 还含有少量 Fe3+、Al3+、Cu2+。
请回答:
步骤Ⅲ中 LiCoO2 固体溶解的化学方程式为 ;

①配制约 0.30mol•L﹣1 盐酸溶液不需要用到的仪器有 (填编号)
a. 量筒 b.电子天平 c. 漏斗 d. 烧杯 e. 容量瓶 f. 玻璃棒 g. 胶头滴管
②用 0.3000mol•L﹣1 盐酸标准溶液滴定,其中正确操作步骤的顺序为
a. 加入 0.1-0.2mL 甲基红—溴甲粉绿作指示剂;
b. 煮沸去除 CO2 , 再冷却到室温;
c. 将试样置于 250mL 锥形瓶中,加入 20mL 水溶解;
d. 用盐酸标准液滴定至试液由绿色变成酒红色;
e. 继续滴定至酒红色(滴定突跃区域)即为终点
③碳酸锂的纯度可用下式计算:ω= ×100%
其中:ω—碳酸锂试样的纯度; m—碳酸锂试样的质量(g);
c—盐酸标准液的浓度(mol•L﹣1)
V1—试样滴定时消耗盐酸的体积(mL);
V0—滴定空白溶液(指不加试样进行滴定)时标准盐酸消耗的体积(mL)0.03694—与 1.00mL 标准盐酸(c=1.000 mol•L﹣1)相当的碳酸锂的质量(g) 滴定空白溶液的目的是
上述滴定操作中,缺少“煮沸去除 CO2 , 再冷却到室温”这个步骤,测定结果将
(填“偏大”、“偏小”、“无影响”)
①含有苯环;②能发生水解反应,水解产物之一是 α-氨基酸,另一水解产物分子中只有 2
种不同化学环境的氢。
 和(CH3)2SO4 为原料制备
和(CH3)2SO4 为原料制备