 CO2的验满
B .
CO2的验满
B .  干燥氧气
C .
干燥氧气
C .  检验气密性
D .
检验气密性
D .  实验室即关即停制取H2
实验室即关即停制取H2
 地壳中各元素质量分数
B .
地壳中各元素质量分数
B .  金属活动性
C .
金属活动性
C .  硫元素的化合价
硫元素的化合价


①Mg2+ ②Mg2+和Fe2+ ③Fe2+和Cu2+ ④Mg2+、Fe2+和Cu2+
| A.对鉴别方法的认识 | B.对化学用语与意义认识 |
| ①区分硬水和软水—加肥皂水后搅拌 ②鉴别纯铜和黄铜—相互刻划 ③鉴别O2、H2、空气、N2—燃着的木条 | ①2个氢分子—2H ②2个铁离子—2Fe2+ ③保持氧气化学性质的最小微粒—O |
| C.对现象的认识 | D.对安全的认识 |
| ①变瘪的乒乓球热水中恢复原样是因为分子间隙变大 ②洗洁精能除去油污利用溶解的原理 ③金刚石和石墨物理性质相差较大﹣碳原子的排列方式不同 | ①为防止一氧化碳中毒,在室内放一盆水 ②进入沼气池前要做灯火实验 ③点燃可燃性气体前都需要验纯 |
 验证Fe、Cu、Ag的金属活动性强
B .
验证Fe、Cu、Ag的金属活动性强
B .  探究溶剂种类对物质溶解性的影响
C .
探究溶剂种类对物质溶解性的影响
C .  验证质量守恒定律
D .
验证质量守恒定律
D .  探究影响物质溶解速率的因素
探究影响物质溶解速率的因素
| 选项 | 实验目的 | 实验方案 |
| A | 除去N2中有少量O2 | 将气体缓缓通过灼热的炭粉 |
| B | 除去CaO中有少量CaCO3 | 加足量的水溶解,过滤 |
| C | 除去CaCl2溶液中的少量盐酸 | 加适量的铁粉 |
| D | 除去CO2中有少量CO | 灼热的CuO |
 AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
B .
AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
B .  等质量镁粉、铁粉中分别加入足量等浓度的稀硫酸
C .
等质量镁粉、铁粉中分别加入足量等浓度的稀硫酸
C .  用两份等质量、等浓度的过氧化氢溶液分别制取氧气
D .
用两份等质量、等浓度的过氧化氢溶液分别制取氧气
D .  向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉

①冷却到室温
②弹簧夹夹紧橡皮管
③点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧



(阅读提示)①实验前,装置内的空气已排尽;
②实验过程中的尾气已处理。
③无水硫酸铜是白色粉末,吸水后变蓝。


①把图中反应物的微观示意图补画齐全;
②该反应的化学方程式为,基本反应类型为。
|
转化类型 |
转化的化学方程式 |
反应用途 |
|
碳元素化合价升高 |
|
工业炼铁 |
|
碳元素化合价不变 |
|
|

|
铜 |
铝 |
|
|
密度/(gcm-3) |
8.92 |
2.70 |
|
地壳中含量(质量分数/%) |
0.007 |
7.73 |
|
导电性(以银的导电性为100做标准) |
| |

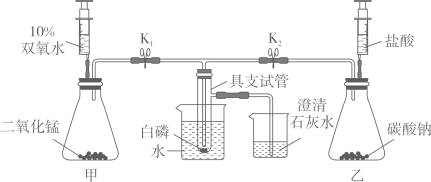
[实验目的]探究可燃物燃烧的条件
[实验步骤]①将所需仪器按照装置图连接起来;
②打开K1和K2 , 向上拉动任意一支注射器的活塞;
③将实验所需药品加入对应的仪器中;
④将装有适量白磷的具支试管放入冷水中;
⑤打开K1 , 关闭K2 , 往装置甲中加入适量的双氧水,氧气进入具支试管中;
⑥关闭K1 , 打开K2 , 往装置乙中加入适量的盐酸,二氧化碳进入具支试管中;
⑦将装有适量白磷的具支试管放入80℃的热水中;
⑧打开K1 , 关闭K2 , 往装置甲中加入适量双氧水,氧气进入具支试管中;
⑨关闭K1 , 打开K2 , 往装置乙中加入适量的盐酸。
[问题解答]
[实验结论]可燃物燃烧必须同时满足两个条件:可燃物与氧气接触;温度达到可燃物的着火点。

|
烧杯质量 |
样品的质量 |
稀盐酸的质量 |
烧杯+剩余物的总质量 |
|
50g |
5.8g |
94.6g |
150.2g |
注:碳既不溶于水也不与稀盐酸发生反应。