

| 选项 | 实验操作和现象 | 预期实验目的或结论 |
| A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐试样不含KIO3 |
| B | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡: |
| D | 室温下向CuCl2和少量FeCl3的混合溶液中,加入铜屑,充分搅拌,过滤,得蓝绿色溶液 | 除去杂质FeCl3得纯净CuCl2溶液 |

下列说法正确的是( )

已知:①酸浸后的溶液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4 | 9 |
| 沉淀溶解时的pH | — | — | >8溶解 | >9溶解 |
|
银盐性质 |
AgCl |
AgI |
AgCN |
Ag2CrO4 |
AgSCN |
|
颜色 |
白 |
黄 |
白 |
砖红 |
白 |
|
Ksp |
1.8×10-10 |
8.3×10-17 |
1.2×10-16 |
3.5×10-11 |
1.0×10-12 |
①滴定时可选为滴定指示剂的是(填编号),
A.NaCl B.K2CrO4 C.KI D.NaCN
②如何确定该滴定过程的终点:。
|
时间/min |
0 |
10 |
20 |
30 |
40 |
|
总压强/100kPa |
1.0 |
1.2 |
1.3 |
1.4 |
1.4 |
①平衡时,容器中气体总物质的量为mol,H2O的转化率为。
②该温度下反应的平衡分压常数Kp=kPa(结果保留2位有效数字)。

①40min时,再充入的H2的物质的量为mol。
②40~50 min内H2的平均反应速率为mol·L-1·min-1。

①放电时,电极A为极,S发生反应(填“氧化”或“还原”)。
②充电时,总反应为Na2Sx=2Na+Sx(3<x<5),Na所在电极与直流电源极相连,阳极的电极反应式为。
①基态Co原子核外电子排布式为;
②基态磷原子中,电子占据的最高能层符号为;该能层能量最高的电子云在空间有个伸展方向。

这类磷酸根离子的化学式可用通式表示为(用n代表P原子数)。
②Li2O具有反萤石结构,晶胞如图所示,已知其晶胞参数为0.4665nm,NA为阿伏加德罗常数的值,则Li2O的密度为g·cm-3(列出计算式)。


可采用的合成路线如图所示:

已知:①A的产量是衡量一个国家石油化工发展水平的重要标志之一。
② 

③RCOORl+R2OH→RCOOR2+R1OH(R、R1、R2表示烃基)
试回答下列问题:
①芳香化合物;②一定条件下能发生银镜反应;③能与NaHCO3溶液反应生成气体。
A. 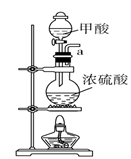 B.
B. 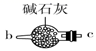 C.
C.  D.
D. 
请说出图B中盛装碱石灰的仪器名称。用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,反应的化学方程式是;实验时,不需加热也能产生CO,其原因是。
资料:ⅰ.常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,可用于检验CO;
ⅱ.一定条件下,CO能与NaOH固体发生反应:CO+NaOH HCOONa
利用下列装置进行实验,验证CO具有上述两个性质。

打开k2 , F装置中发生反应的化学方程式为;为了使气囊收集到纯净的CO,以便循环使用,G装置中盛放的试剂可能是,H装置的作用是。