 倾倒液体
B .
倾倒液体
B .  点燃酒精灯
C .
点燃酒精灯
C .  稀释浓硫酸酸入水
稀释浓硫酸酸入水




 是电池回收标志
D . 用食醋可除去热水瓶胆壁上的水垢
是电池回收标志
D . 用食醋可除去热水瓶胆壁上的水垢
| 选项 | 实验目的 | 实验用品或实验操作 |
| A | 制汽水 | 用柠檬酸、果汁、白糖、水、小苏打等 |
| B | 制作简易净水器 | 用空塑料瓶、小卵石、石英砂、活性炭、膨松棉等 |
| C | 防止一氧化碳中毒 | 煤炉上放一盆水 |
| D | 自制酸碱指示剂 | 捣烂某些植物的花瓣,加入酒精(乙醇与水的体积比为1 : 1)浸泡 |


| 选项 | 待鉴别的物质 | 鉴别方法 |
| A | CO2与O2 | 燃着的木条,观察木条燃烧情况 |
| B | 棉线与羊毛线 | 点燃,闻产生的气味,观察生成的灰烬 |
| C | NaOH与Na2CO3 | 溶于水,滴加酚酞溶液,观察溶液的颜色变化 |
| D | AgCl与NaCl | 加水,观察是否溶解 |

| A 守恒观 | B 能量观 |
| 某物质燃烧后生成二氧化碳和水,可推测出该物质中一定含有碳、氢元素,可能含有氧元素 | 过氧化氢、高锰酸钾、氯酸钾制取氧气都是吸热反应 |
| C 微粒观 | D 分类观 |
| 酸、碱、盐都是由离子构成的 | 含有氧元素的化合物都是氧化物。含有碳元素的化合物都是有机物 |

| 选项 | 物质 | 杂质(少量) | 试剂 | 操作方法 |
| A | KCl溶液 | CaCl2 | 过量的K2CO3溶液 | 过滤 |
| B | Fe | Cu | 足量的稀硫酸 | 溶解、过滤、洗涤、干燥 |
| C | NaOH溶液 | Ca(OH)2 | 适量的Na2CO3溶液 | 过滤 |
| D | CO | CO2 | 足量的氧化铜 | 加热 |
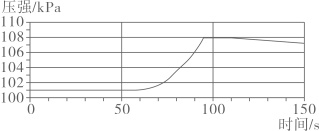
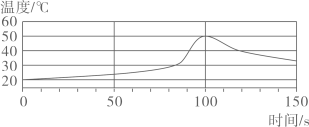

A.酸性 B.中性 C.碱性 D.无法确定

|
温度/℃ |
10 |
20 |
30 |
40 |
|
|
溶解度/g |
Na2CO3 |
12.2 |
21.8 |
39.7 |
48.8 |
|
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
|
|
NaHCO3 |
8.2 |
9.6 |
11.1 |
12.7 |
|
I.生成NaHCO3的化学方程式为。
II.结合上表,NaHCO3固体结晶析出的原因可能有(填字母序号)。
A.同温下NaHCO3溶解度小于NaCl
B.溶剂质量减少
C.生成的NaHCO3质量大于消耗的NaCl质量
(写化学方程式)。

[豆腐的制作]

[腐乳的制作]
豆腐切块→长出毛霉→加盐腌制(析出水分,豆腐块变硬,抑制微生物生长,避免豆腐块腐败变质)→加卤汤装瓶(形成独特风味)→密封腌制发酵。前酵是培菌累积酶系的过程,一般为36~48h, 后醇是酶系作用于腐乳坯体的过程,耗时较长,一 般为3~6个月。腐乳发酵过程中食盐和嘌呤含量较高,高血压、心血管病、痛风、肾病患者及消化道溃疡患者,宜少吃或不吃。腐乳发醇过程中食盐含量对组分的影响如图所示。

回答问题:

资料链接:①SiO2不溶于水,不溶于稀盐酸,不与稀盐酸反应;
②CaCl2.6H2O的溶解度随温度的升高而增大。
回答问题:

资料链接:①草酸亚铁晶体(FeC2O4.2H2O)是浅黄色、难溶于水、受热易分解的固体。
②无水硫酸铜遇水会变成蓝色。
[猜想假设]猜想一:X、CO2
猜想二:X、CO
猜想三:X、CO、CO2 , 物质X为(填化学式)。

选择_________(填字母序号)作为虚线中的“热分解装置”
①C中反应的化学方程式为。
②该装置并不能严谨证明猜想三成立,改进的措施是在C和D装置之间增加盛有(填名称)溶液的洗气瓶。
[数据分析]
称取3.60g草酸亚铁晶体( FeC2O4﹒2H2O,为相对分子质量为180),用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示。300℃时,剩余固体为纯净物且是铁的氧化物,通过计算确定该物质的化学式为。

