 是重要有机化工产
是重要有机化工产 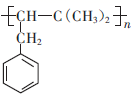 的单体
D . 二环[1,1,0]丁烷(
的单体
D . 二环[1,1,0]丁烷(  B . 吸收尾气中的二氧化硫
B . 吸收尾气中的二氧化硫  C . 溶解反应后烧瓶内混合物中的硫酸铜固体
C . 溶解反应后烧瓶内混合物中的硫酸铜固体  D . 加热硫酸铜溶液制备胆矾
D . 加热硫酸铜溶液制备胆矾 
实验原理:
已知:① 熔点为83℃,易潮解,易升华,易溶于水,高温下易被氧气氧化;
② 沸点为57.6℃;
③在碱性条件下, 能把
氧化为
;
在酸性条件下, 能把
还原为
。
回答下列问题:
利用工业氮气(混有 、
、
)制取纯净干燥的氮气的实验装置如图1。按气流方向(用小写字母表示)写出其合理的连接顺序:a→。

实验装置如图2所示(加热、夹持等装置已略去)。

通入 的作用是(写出2点)。
a.称取
产品,在强碱性条件下,加入过量的30%
溶液,小火加热使
完全转化为
,继续加热一段时间;
b.冷却后加适量的蒸馏水,再滴入适量的浓 和浓
,使
转化为
;
c.用新配制的 硫酸亚铁铵标准溶液滴至橙红色变浅(反应原理:
),加入5滴二苯胺磺酸钠指示剂,继续滴定至溶液由紫蓝色转变为亮绿色且半分钟内不变色即为终点。重复实验3次,平均消耗标准溶液18.00mL。
回答下列问题:
①上述操作a中“继续加热一段时间”的目的是。
②加浓 的目的是为了防止指示剂提前变色。若不加浓
,则测得的
的质量分数将(填“偏低”、“偏高”或“不变”)。
③产品中 的质量分数为%(保留一位小数)。

|
金属离子 |
开始沉淀的pH |
完全沉淀的pH |
|
| l. 8 | 3.2 |
| | 3.0 | 5.0 |
| | 5.8 | 8.8 |
| | 7.8 | 9.8 |

工业上可采用 的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。

①该反应历程中正反应的最大活化能为 。
②合成氨反应的热化学方程式为。
①M点的 N点的
(填“>”、“<”或“=”)。

② ℃时,将
和
充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=
(用最简分数表示)。
①用次氯酸钠除去氨氮(以 示)的原理如图3所示。写出总反应的化学方程式:。


②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应相同时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随 的变化情况如图4所示。当
时,水体中总氮去除率反而下降,可能的原因是。

①B电极的电极反应式是.
②常温下,除去10L废水中的
后,最终废水的
(电解前后废水的体积变化忽略不计)。

 已知:
已知: ①
② 
回答下列问题:
B的化学名称为。
①苯环上含有硝基且苯环上只有一种氢原子;
②遇 溶液发生显色反应;
③1mol的X与足量金属Na反应可生成2g 。
 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
其中能量最低的是(填标号),电子由状态C到状态B所得到的光谱为光谱(填“原子发射”或“原子吸收”)。
①两种硼氢化物的熔点如下表所示:
| 硼氢化物 | | |
| 熔点/℃ | 400 | -64.5 |
解释表中两种物质熔点差异的原因。
②硼氢化钠晶胞结构如图所示,该晶体中 的配位数为。已知:硼氢化钠晶体的密度为
,
代表阿伏加德罗常数的值,则a=nm(用含
、
的最简式子表示)。
