 B . 用装置乙制取无水氯化镁
B . 用装置乙制取无水氯化镁  C . 用装置丙除去氯气中的氯化氢
C . 用装置丙除去氯气中的氯化氢  D . 用装置丁分离苯和四氯化碳
D . 用装置丁分离苯和四氯化碳 


| 选项 | 实验操作和现象 | 结论 |
| A | 将废铁屑溶于过量盐酸,滴入KSCN溶液,未见溶液变为红色 | 该废铁屑中不含三价铁的化合物 |
| B | 向AgCl悬浊液中滴入数滴0.1 mol·L-1 KI溶液,有黄色沉淀生成 | Ksp(AgI)<Ksp(AgCl) |
| C | 向a、b两试管中同时加入4 mL 0.01 mol·L-1 KMnO4溶液和2 mL 0.1 mol·L-1 H2C2O4溶液,再向a试管内加入少量MnSO4 , a试管中溶液褪色较快 | MnSO4是KMnO4和H2C2O4反应的催化剂 |
| D | 向苯酚浊液中加入热的氢氧化钠溶液,浊液变澄清 | 苯酚显酸性 |
 B . 图乙是平衡体系2NO2(g)
B . 图乙是平衡体系2NO2(g) 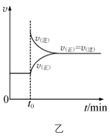 C . 图丙是某温度下c(CH3COOH)+c(CH3COO-)=0.100 mol·L-1的醋酸与醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系,可推知该温度下pH=3的溶液中:Ka<10-4.75
C . 图丙是某温度下c(CH3COOH)+c(CH3COO-)=0.100 mol·L-1的醋酸与醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系,可推知该温度下pH=3的溶液中:Ka<10-4.75  D . 图丁中虚线是2SO2+O2
D . 图丁中虚线是2SO2+O2 


已知:某些过渡元素(如Cu、Fe、Ag等)的离子能与NH3、H2O、OH-、SCN-等形成可溶性配合物。

①含有—SH结构;
②能在酸性条件下发生水解反应,两种水解产物均含有三种不同环境的H原子。其中一种水解产物既能遇FeCl3溶液显色,又能与Br2的CCl4溶液发生加成反应。
Ⅰ. (NH4)xH6-xV10O28·yH2O的制备
将NH4VO3溶于pH为4的弱酸性介质后,加入乙醇,过滤得到(NH4)xH6-xV10O28·yH2O晶体。乙醇的作用是____________________________________。
Ⅱ. (NH4)xH6-xV10O28·yH2O的组成测定
准确称取0.363 6 g该十钒酸铵晶体,加入蒸馏水和NaOH溶液,加热煮沸,生成的氨气用20.00 mL 0.100 0 mol·L-1盐酸标准溶液吸收。用等浓度的NaOH标准溶液滴定过量盐酸,消耗NaOH标准溶液8.00 mL。
步骤1:准确称取0.3636 g该十钒酸铵晶体,加入适量稀硫酸,微热使之溶解。
步骤2:加入蒸馏水和NaHSO3 , 充分搅拌,使V10O 完全转化为VO2+。
步骤3:加适量稀硫酸酸化,加热煮沸,除去溶液中+4价硫。
步骤4:用0.020 00 mol·L-1 KMnO4标准溶液滴定,终点时消耗30.00 mL KMnO4标准溶液(该过程中钒被氧化至+5价,锰被还原至+2价)。
①写出步骤2反应的离子方程式:。
②若未进行步骤3操作,则数值y将(填“偏大”“偏小”或“无影响”)。
③通过计算确定该十钒酸铵晶体的化学式(写出计算过程)。

实验步骤如下:
步骤1:在题图1所示装置的四颈烧瓶内依次加入洗净的矿泉水瓶碎片、氧化锌、碳酸氢钠和乙二醇,缓慢搅拌,油浴加热至180 ℃,反应0.5 h。

步骤2:降下油浴,冷却至160 ℃,将搅拌回流装置改为图2所示的搅拌蒸馏装置,水泵减压,油浴加热蒸馏。
步骤3:蒸馏完毕,向四颈烧瓶内加入沸水,搅拌。维持温度在60 ℃左右,抽滤。
步骤4:将滤液转移至烧杯中加热煮沸后,趁热边搅拌边加入盐酸酸化至pH为1~2。用砂芯漏斗抽滤,洗涤滤饼数次直至洗涤滤液pH=6,将滤饼摊开置于微波炉中微波干燥。
请回答下列问题:


① 该混合溶液中,Al2(SO4)3与Na2SO4的物质的量之比应≥(填数值)。
②在不改变其他条件的情况下,加入NaOH调节溶液pH。实验测得溶液中残留氟浓度和氟去除率随溶液pH的变化关系如图所示。pH>5时,溶液中残留氟浓度增大的原因是。

①请补充完整由废铝屑为原料制备硫酸铝晶体的实验方案:取一定量废铝屑,放入烧杯中,,得硫酸铝晶体。[已知:pH=5时,Al(OH)3沉淀完全;pH=8.5时,Al(OH)3沉淀开始溶解。须使用的试剂:3 mol·L-1 H2SO4溶液、2 mol·L-1 NaOH溶液、冰水]
②实验操作过程中,应保持强制通风,原因是。
2NO(g)+O2(g)=2NO2(g);ΔH=a kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=b kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH= kJ·mol-1。

①写出·OH氧化NO的化学反应方程式:。
②当H2O2浓度一定时,NO的脱除效率与温度的关系如图2所示。升温至80 ℃以上,大量汽化的H2O2能使NO的脱除效率显著提高的原因是,温度高于180 ℃,NO的脱除效率降低的原因是。
① SO2气体在(填“Ⅰ”“Ⅱ”或“Ⅲ”)室生成。
②用离子方程式表示吸收液再生的原理:。
