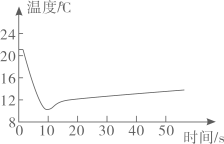

①营养成分表中的“钠”是指(选填“原子”、“分子”或“元素”),主要来源于。
②从营养成分表可知,提供能量的主要物质是。
③该品牌芽菜的外包装袋是由聚丙烯制成,聚丙烯属于(填字母序号)。
A.天然高分子材料
B.有机合成材料
C.金属材料
①化石燃料包括煤、和天然气。
②SO2造成的环境污染问题主要是。
③煤燃烧时需不断鼓入空气,“固硫”最终生成CaSO4。“固硫”的化学方程式是。
新型灭菌消毒剂——ClO2
目前,新冠肺炎疫情肆虐全球。为抑制新冠病毒传播,“含氯消毒剂”被广泛使用,其中就包含一种新型灭菌消毒剂——ClO2在通常情况下,ClO2是一种有刺激性气味的黄绿色气体,熔点-59℃,沸点11℃。在常温下,1L水中大约能溶解2.9gClO2。ClO2受热或者见光易分解,具有强氧化性和很强的腐蚀性。含有2%的ClO2和0.085%Na2CO3的水溶液无色、无臭、无腐蚀性,常温下稳定,不易分解;该溶液用于杀菌、消毒的同时,还有除臭、防霉、保鲜等作用,是特性优良,高效安全的消毒剂。我国从2000起就逐渐用ClO2取代氯气(Cl2)对饮用水进行消毒。

①通CO2时,在溶液B中生成CaCO3 , 该反应的化学方程式是。
②为使溶液B中的物质顺利转化为CaCO3 , 除了通NH3外,还可加入(填字母序号)。
A.NaCl
B.NaOH
C.KOH
D.Ca(OH)2

某化学兴趣小组对发热包进行了如下探究
探究I:发热包的发热原理
将发热包中固体倒入烧杯中,加入适量水,发生剧烈反应,水很快沸腾。反应结束后,烧杯底部有大量固体,继续加水搅拌,过滤、洗涤、干燥,得到固体混合物。
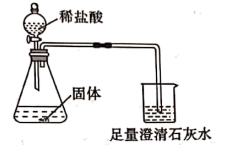
①反应停止后,瓶底的黑色固体为,判断依据是。
②当观察到现象,证明固体中含有CaCO3。
③证明固体中含有铁粉的现象是。