
 ①实验室用高锰酸钾制氧气,反应的化学方程式为;该实验可选用F和(填序号)组装成排水法收集氧气的装置;还可用方法收集氧气。
①实验室用高锰酸钾制氧气,反应的化学方程式为;该实验可选用F和(填序号)组装成排水法收集氧气的装置;还可用方法收集氧气。
②实验室用锌粒和稀硫酸制氢气,反应的化学方程式为;为达到控制反应生和停止的目的,发生装置应选择A和(填序号);为除去氢气中的水分,用B、C组装成一套装置,向B中加入液体试剂,气体通过此装置达到目的。
①量取水,应选择(填“10mL”或“50mL”)量筒。
②下列操作导致氯化钠溶液的溶质质量分数偏大的是(填序号)。
a.取用潮湿的氯化钠
b称量时,所用砝码表面已生锈
c量取水时仰视读数
d转移溶液后,烧杯内还有少量氯化钠固体
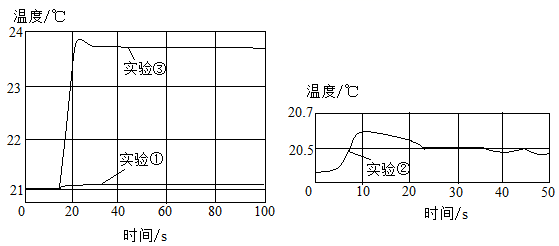
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。
在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为。
查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想是错误的,理由是。
实验验证:取样,滴加,无气泡产生,猜想三不正确。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色(填“一定”或“不一定”)变红。