①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI (g) ![]() H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深

①增大A的浓度 ②升高温度 ③增大D浓度 ④加入催化剂 ⑤恒温下,缩小反应容器体积 ⑥加入稀有气体,保持容器内压强不变
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |

 B .
B . 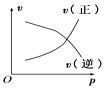 C .
C .  D .
D . 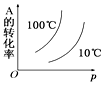
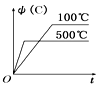
①T100℃(填“大于”“小于”),判断理由是。
②列式计算温度T是反应的平衡常数K2
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1 173 K | 2.15 | 1.67 |
请填空:

①图甲中t2时刻发生改变的条件是。
②图乙中t2时刻发生改变的条件是。
已知25℃、101kPa时:
①C(s)+ O2(g)=CO(g) ΔH=-126.4kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
则在25℃、101kPa时:
C(s)+H2O(g)=CO(g)+H2(g) ΔH=。
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”“减小”或“不变”)。
②1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应是否处于化学平衡状态?(填“是”或“否”),其判断依据是。
现向体积为1L的恒容密闭容器中,充入1molCO2和3molH2 , 反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=。
②下列措施能使 增大的是(填字母)。
A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大