蒸发食盐水
B .
蒸发食盐水
B .  铁丝在氧气中燃烧
C .
铁丝在氧气中燃烧
C .  称量NaOH固体的质量
D .
称量NaOH固体的质量
D .  检验装置气密性
检验装置气密性
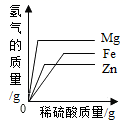 分别向相同质量的镁粉、铁粉、锌粉中加入等浓度稀硫酸
B .
分别向相同质量的镁粉、铁粉、锌粉中加入等浓度稀硫酸
B . 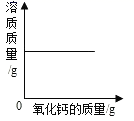 一定温度下,向饱和的氢氧化钙溶液中加入氧化钙固体
C .
一定温度下,向饱和的氢氧化钙溶液中加入氧化钙固体
C .  向一定量铁锈中加入稀盐酸
D .
向一定量铁锈中加入稀盐酸
D .  向一定量硝酸银溶液中加入铜粉
向一定量硝酸银溶液中加入铜粉

①  的微粒符号;
的微粒符号;
②标出过氧化氢中氧元素的化合价。
①“捕捉”CO2:在高压时将烟道气中的CO2溶解于甲醇,得到CO2的甲醇溶液。所得溶液中溶质是。
②用“捕捉”CO2生产甲醇,反应的微观示意图如下:

该反应的化学方程式为。
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
|
溶解度/g |
Ca(OH)2 |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
|
NaOH |
31 |
91 |
111 |
129 |
313 |
336 |
|

①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。其中措施正确的是。
A ②④⑥ B ③④ C ①③⑤⑥ D ①②⑤⑥

请回答:

已知A为铝土矿的主成分,通常情况下F是一种液体,C、D、H、I为气体,H能参与绿色植物的光合作用,G为黑色固体。
请回答下列问题:

A 食盐没有全部溶解即过滤 B 蒸发时食盐飞溅剧烈
C 蒸发后,所得精盐很潮湿 D 器皿上沾有的精盐没全部转移到称量纸上
①需要10%的氯化钠溶液g。
②配制过程中的操作步骤为:计算、、、装瓶。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
| 物质 | NaCl | | | |
| 溶液度/g | 36.0 | 21.6 | 37.2 | 9.6 |
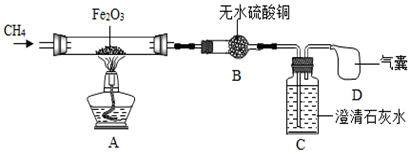
(提出问题)氢气、一氧化碳具有还原性,那么甲烷有没有还原性呢?
(查阅资料)1.无水硫酸铜是白色固体,吸收水分后变为蓝色。2.铁的氧化物与稀硫酸反应时无气体生成
(实验探究)为探究上述问题,设计如下装置并进行实验。