 B .
B .  C .
C .  D .
D . 

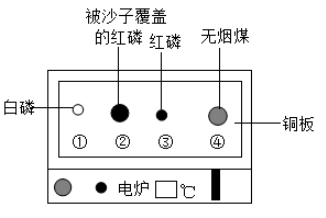
 验证质量守恒定律
B .
验证质量守恒定律
B .  探究合金与纯金属的硬度
C .
探究合金与纯金属的硬度
C .  判断铝、铜、银的金属活动性顺序
D .
判断铝、铜、银的金属活动性顺序
D .  制取二氧化碳
制取二氧化碳

| 实验目的 | 实验操作 | |
| A | 除去二氧化碳中的一氧化碳 | 将气体在氧气中点燃 |
| B | 除去碳粉中的氧化铜 | 在空气中灼烧至质量不再发生变化 |
| C | 除去银粉中的锌粉 | 加入过量的稀盐酸,充分反应后过滤、洗涤、干燥 |
| D | 除去 KCl 固体中的 KClO3 | 加入少量的二氧化锰,并加热至质量不再发生变化 |



①在一定温度、一定压强和催化剂存在的条件下,环节Ⅰ除生成 CO 外,还生成了一种常见的氧化物,则反应的化学方程式为 。该反应中, 二氧化碳发生了 反应(填“氧化”或“还原”)。
②认真观察 c 和 d 两种物质的分子结构模型,c 物质的化学式,c 和d的化学式(填“相同”或“不相同”)。
③“二氧化碳变汽油”的研究成果,使我国成为此领域的世界领跑者。你认为该成果的现实意义是。
6ZnFe2O4 6ZnO+4Fe3O4 + O2 、3ZnO+2Fe3O4 + H 2O
3ZnFe2O4 + H 2 ,该循环制氢中不断消耗的物质是(填化学式),得到两种气体产物的质量比为。

①乙物质的溶解性属于(填“易溶”或 “可溶”或“微溶”或“无法确定”)。
②A 是 40℃含有 120g 水的甲溶液,经过如下操作, 得到 50g 甲固体。

对以上过程的分析,正确的是(选填编号)
a A 到 B 的过程中,溶质质量没有改变 b B 中溶质与溶剂的质量比为 138:100
c B 到 C 的过程中,溶质甲已全部析出 d A 溶液的质量等于 255g
③40℃,将甲、乙物质饱和溶液各 200g 降温至 20℃,对此过程判断一定正确的是。
Ⅰ.现象:有析出晶体,甲溶液析出固体质量>乙溶液析出固体质量
Ⅱ.溶解度:溶解度都变小;20℃时:S 甲<S 乙
Ⅲ.溶液状态:都为饱和溶液;40℃:甲溶质的质量<乙溶质的质量
Ⅳ.溶剂变化:溶质质量不变;20℃时:甲溶液中溶剂质量>乙溶液中溶剂质量
④40℃,向 100g 水中加入 143g 甲物质,搅拌后发现全部溶解,但放置一段时间后又有少量 甲物质的晶体析出(不考虑甲与空气中的物质反应和水的蒸发),“全部溶解”的原因可能 是 。

①0-50s,发生反应的化学方程式是;
②50s 时,溶液中的溶质为(填化学式)
③100-140s,压强减小的原因为。
(实验回顾)用如图 1 所示装置,利用铁生锈的原理可以比较准确地测出空气中氧气的含量。
(提出问题)若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气 中氧气的含量?
(查阅资料)铜能与空气中氧气、水、二氧化碳反应生成铜绿,化学方程式:2Cu+O2+H2O+CO2=Cu2(OH)2CO3
①如图 3是实验室拟工业制备硫酸铜的装置,采用水浴加热的优点是, 多孔球泡的作用为。

②工业生产时可用纯氧代替空气。这一措施能加快反应速率外,还具有的优点是。
③用如图 1所示装置制备氧气,反应的化学方程式为, 收集一瓶氧气的方法是:当气泡连续均匀冒出时,把导管伸入盛满水的集气瓶中,氧气充满 集气瓶后,,把集气瓶拿出水槽,正放于实验桌。

①实验开始前应先关闭,打开。
②装置 B 的作用是。
③铜元素有多种氧化物,如 CuO、Cu2O。根据实验数据进行计算,该固体样品成分可能是(填序号)。
A.Cu2O B.Cu、CuO C.CuO、Cu2O D.Cu、CuO、Cu2O
