三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 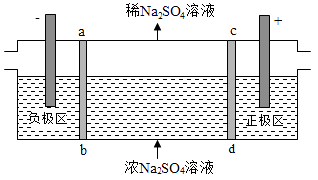
298K时,在20.0mL 0.10mol•L﹣1氨水中滴入0.10mol•L﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L﹣1氨水的电离度为1.32%,下列有关叙述正确的是( )

短周期元素W,X,Y,Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L﹣1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( ) 
氨气的制备
①氨气的发生装置可以选择上图中的,反应的化学方程式为.
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示).
氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验.

操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③ | ④ |
CrO42﹣和Cr2O72﹣在溶液中可相互转化.室温下,初始浓度为1.0mol•L﹣1的Na2CrO4溶液中c(Cr2O72﹣)随c(H+)的变化如图所示.
①用离子方程式表示Na2CrO4溶液中的转化反应.
②由图可知,溶液酸性增大,CrO42﹣的平衡转化率(填“增大“减小”或“不变”).根据A点数据,计算出该转化反应的平衡常数为.
③升高温度,溶液中CrO42﹣的平衡转化率减小,则该反应的△H(填“大于”“小于”或“等于”).
[化学--选修2:化学与技术]高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等.以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4 , MnO2和(写化学式).
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
, 阴极逸出的气体是.
③“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为.
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | ﹣49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
);C为(
,
,0).则D原子的坐标参数为.

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为 g•cm﹣3(列出计算式即可).
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物