|
选项 |
混合物 |
纯净物 |
单质 |
电解质 |
|
A |
盐酸 |
NaOH |
石墨 |
K2SO4溶液 |
|
B |
空气 |
Fe(OH)3胶体 |
铁 |
Na2CO3 |
|
C |
CuSO4·5H2O |
CaCl2 |
水银 |
铜 |
|
D |
氯水 |
KNO3晶体 |
O3 |
NaCl |
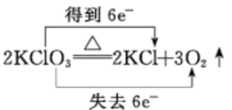 B .
B . 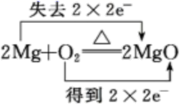 C .
C . 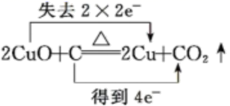 D .
D . 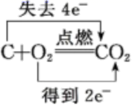
 C .
C . | 选项 | 实验操作及现象 | 推理或结论 |
| A | 向某溶液中加入BaCl2溶液,生成白色沉淀 | 该溶液中一定含有 |
| B | 向水中加入金属钠,钠熔成闪亮的小球浮在水面上 | 钠与水反应放热 |
| C | 向某钠盐溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 该盐一定是碳酸钠 |
| D | 向包有Na2O2粉末的棉花上滴加几滴水,棉花燃烧 | Na2O2与水反应放热 |

装置①中反应的化学方程式是。
a.饱和 溶液
b.饱和 液
c.浓
步骤1:打开弹簧夹 ,关闭
,打开分液漏斗活塞,加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹 ,关闭
,打开分液漏斗活塞,加入盐酸,将带火星的木条放在a处。
步骤1和步骤2中,a处带火星的木条产生的实验现象分别是。
①有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠与二氧化碳发生了化学反应。”其理由是。
②需要补充的实验操作:取装置⑤中反应后的少量固体,。




已知:
①HClO2可视为强酸,NaClO2的溶解度随温度升高而增大。
②ClO2的沸点为10℃,纯ClO2易分解爆炸。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4