 C . 聚乙烯的结构简式:
C . 聚乙烯的结构简式:  互为同系物
C . 16O和18O是同素异形体
D . 乙醇和乙醚互为同分异构体
互为同系物
C . 16O和18O是同素异形体
D . 乙醇和乙醚互为同分异构体
 的说法正确的是( )
的说法正确的是( )
| | 1.01×102 | 5.05×102 | 1.01×103 | 1.01×104 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9. |
| 200 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
在实际生产中,下列条件最适宜的是( )

H2S(g)+ O2(g)=SO2(g)+H2O(g) ΔH1
H2S(g)+ O2(g)=S(g)+H2O(g) ΔH2
2H2S(g)+SO2(g)= S8(s)+2H2O(l) ΔH3
2H2S(g)+SO2(g)= S8(g)+2H2O(g) ΔH4
8S(g)=S8(g) ΔH5


组成X的三种元素是(填元素符号),X的化学式是。
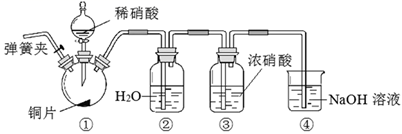
某同学认为虽然装置②液面上方的无色气体为NO,但不能说明装置①反应一定生成NO。理由是。
I.2CO2(g)+6H2(g) C2H4(g)+4H2O(g)ΔH1
II.CO2(g)+H2(g) CO(g)+H2O(g)ΔH2>0
请回答下列问题:

①下列说法正确的是
A.由图1可知:0.1MPa下,200℃~550℃时以反应I为主,550℃以后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以反应II的ΔS等于零
C.恒温恒压下,容器内气体的密度不变时,说明反应已达平衡
D.其他条件不变,将CO2和H2的初始物质的量比改变为2:3,可提高CO2平衡转化率
②图1中点M(350,70)、此时乙烯的选择性为 (选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =。
③在图1中,温度大于800℃时,随着压强的增大,CO2的平衡转化率减小,请解释原因。
i CO2(g)+H2(g) CO(g)+H2O(g)慢
ii 2CO(g)+4H2(g) C2H4 (g)+2H2O(g)快
在图2中画出反应I分两步进行的“能量−反应过程图”。起点从[2CO2(g)+6H2(g)]开始。


合成反应:步骤Ⅰ: 2NaClO3+SO2=2ClO2+Na2SO4
步骤Ⅱ: 2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2
已知:a.NaClO2晶体易溶于水,与有机物接触能引起爆炸。
b.NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl。
请回答:
①步骤Ⅰ的SO2可用亚硫酸钠与70%~80%的硫酸反应制备,而不用98%的浓硫酸或极稀的硫酸,原因是;
②步骤Ⅱ的反应放热效应明显,为提高NaClO2的产率,实验中可采取的措施是(任填一项措施)。

滴定反应:ClO +4I-+4H+=2H2O+2I2+Cl-
2S2O + I2=S4O
+2I-
①待测液的配制一般可以分为以下几个步骤:a 称量mg NaClO2产品;b 溶解,加过量KI,适量的稀H2SO4;c 倒转摇匀;d 转移至100mL容量瓶;e 洗涤;f 定容;g 冷却。其正确的操作顺序为:→ d e d →。
②移取25mL待测液,以淀粉为指示剂,用c mol·L-1Na2S2O3标准液滴定至终点,消耗标准液V mL。计算产品中NaClO2的质量分数为。(用含m、c、V的代数式表示)
③检验发现制备的NaClO2中含有Na2SO4 , 出现这种杂质的可能原因是。
①1H-NMR谱和IR谱检测表明:分子中共有3种氢原子,无碳氮双键、氧氧单键和—NO2;
②除了苯环外无其他环。