| A | B | C | D |
| | | | |
| 燃气灶 | 太阳能热水器 | 纽扣电池 | 太阳能电池 |
H2(g)+ O2(g) =H2O(g) ΔH1=-a kJ·mol-1
H2(g)+ O2(g) =H2O(l) ΔH2=-b kJ·mol-1
2H2(g)+O2(g) =2H2O(l) ΔH3=-c kJ·mol-1
下列关系正确的是( )
①b>a ②b<a ③2a>c ④2b=c


 B .
B . 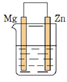 C .
C . 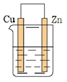 D .
D . 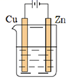






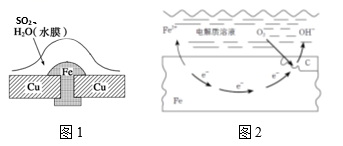
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
已知:煤气化反应为C(s) + H2O(g) = CO(g)+H2(g) ΔH
① C(s)+O2(g) = CO2(g) ΔH1=-393.5 kJ/mol
② CO(g)+ O2(g) = CO2(g) ΔH2=-283.0 kJ/mol
③ H2(g)+ O2(g) = H2O(g) ΔH3=-242.0 kJ/mol

a为电解池的极,a处的电极反应式为。
利用实验室装置制备NaOH,不仅有安全隐患,而且存在Cl2与NaOH的副反应,氯碱工业采用改进后的装置,如图2所示。
① 气体X和气体Y被阳离子交换膜分隔开,避免混合爆炸。气体X是,气体Y是。
②阳离子交换膜避免了Cl2与NaOH发生反应,可得到NaOH浓溶液,简述NaOH浓溶液的生成过程。
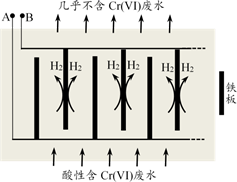
已知:pH=3.2时Fe3+完全转化为Fe(OH)3;pH=5.6时Cr3+完全转化为Cr(OH)3

①电池的正极反应式为:,负极反应式为:。
②该电池工作时,H+的移动方向是由极经质子交换膜流向极(填“a”或“b”)。
③ 甲醇可作为内燃机燃料,也可用于制作燃料电池,其反应均为甲醇与氧气的反应,但能量转化形式不同,电池将化学能转化为电能的根本原因是。

|
设计思路 |
||
|
负极 |
负极材料 |
|
|
负极反应物 |
||
|
正极 |
正极材料 |
|
|
正极反应物 |
||
|
电子导体 |
|
|
|
离子导体 |
|
|
在方框内画出简单的装置示意图,并标明使用的材料和试剂。
