 B . 熄灭酒精灯
B . 熄灭酒精灯  C . 检查气密性
C . 检查气密性  D . 振荡试管
D . 振荡试管 
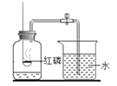 B . 既能说明CO2的密度比空气大,又能说明CO2不可燃也不助燃
B . 既能说明CO2的密度比空气大,又能说明CO2不可燃也不助燃 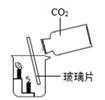 C . 既能说明燃烧需要O2 , 又能说明燃烧需要温度达到着火点
C . 既能说明燃烧需要O2 , 又能说明燃烧需要温度达到着火点 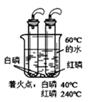 D . 既能说明CO2能溶于水,又能说明CO2具有酸性
D . 既能说明CO2能溶于水,又能说明CO2具有酸性 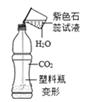

 B . 两份等质量的氯酸钾在有、无MnO2的情况下加热产生氧气
B . 两份等质量的氯酸钾在有、无MnO2的情况下加热产生氧气 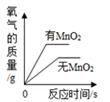 C . 向饱和澄清石灰水中加入少量CaO
C . 向饱和澄清石灰水中加入少量CaO  D . 20℃时向硝酸钾的不饱和溶液中不断加入固体硝酸钾
D . 20℃时向硝酸钾的不饱和溶液中不断加入固体硝酸钾 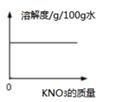
①PM2.5口罩中使用了活性炭,这是利用了活性炭的作用。
② 用硫酸铜检验某样品中含有水,实验现象,反应的化学方程式是。
③ 用化学符号表示:空气中含量最多的气体;两个铝原子;
由于化学性质稳定而代替氢气填充探空气球的气体是;
引起酸雨的主要物质是;保持水化学性质的最小微粒。
④ 氢气是绿色能源,燃烧的化学方程式为。
⑤ 自然界中石灰岩逐渐变成碳酸氢钙【Ca(HCO3)2】形成溶洞。碳酸氢钙的组成元素有种,其中氢原子与氧原子的物质的量之比是;0.5mol该物质中钙元素的质量是g,约含碳原子个。
① 自来水厂净水加明矾 [化学式为KAl(SO4)2·12H2O] 的作用是,其含有的原子团名称是;加液氯的目的是。
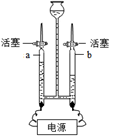
② 电解水实验如右下图所示,实验现象,a玻璃管中生成的气体是。
③ 电解水发生化学反应的微观示意图如下:

从示意图中可获得的正确信息(填写编号)。
A.反应前后共有6种原子,4种分子 B.反应前后元素种类不变,都为3种
C.化学变化的实质是原子的重新组合 D.化学变化中分子是最小的微粒
E.生成氢、氧两种分子的个数比是2∶1 F.水是由氢气和氧气组成
④ 电解水的化学方程式为 ,反应的基本类型是。

① a点表示。
② 60℃时,50g水中加入g硝酸钾恰好形成饱和
溶液,再往该溶液中加入115g水后,硝酸钾溶液的溶质
质量分数是。
③ 提纯混合溶液中的硝酸钾,进行如下实验。

操作II的名称为,溶液M中所含溶质为 。
④ 20℃时,将等质量的NaCl、KNO3固体分别加入到盛有100g水的烧杯中,充分搅拌后现象如
图1,加热到60℃时现象如图2(不考虑水分蒸发)。根据NaCl、KNO3物质的溶解度曲线回答:
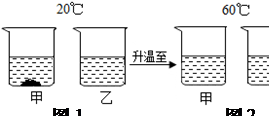
甲烧杯中加入的固体是(填“KNO3”或“NaCl”)。
对乙烧杯中溶液的分析,正确的是(选填编号)
Ⅰ.从20℃升温到60℃,溶质质量没有改变 Ⅱ.若对20℃溶液降温,一定会析出晶体
Ⅲ.20℃时,溶质与溶剂的质量比为31.6:100 Ⅳ.60℃时,溶液一定是不饱和溶液

① 装置B的名称是 。
② 若选用A装置制氧气,反应的化学方程式为,向试管中加入药品的正确操作是。
Ⅰ.先加氯酸钾,后加二氧化锰
Ⅱ.先加二氧化锰,后加氯酸钾
Ⅲ.加入混合均匀的氯酸钾和二氧化锰
某同学用A装置制备氧气时发现试管位置太高,不能用外焰加热,则应调节下图中的旋钮 (填“①”、“②”或“③”)。
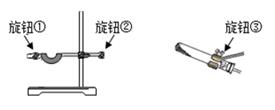
③ 选择C装置收集氧气,当看到 , 说明气体收集满了。
④ 实验室制备CO2的化学方程式是,常选B作为发生装置,选择依据是,其优点是。若用F装置收集CO2 , 气体从(填“m”或“n”)端通入,验满的方法是。集满一瓶CO2气体后,关闭玻璃活塞,待反应完全停止后,容器中的液面位置是(填“a”、“b”或“c”)。
⑤ 如图是铁在不同情况下与氧气反应的实验。
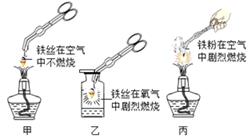
比较实验甲与乙,产生不同现象的原因是;实验乙中集气瓶预留少量水的作用是;
实验丙与乙的产物相同,写出反应的化学方程式。
⑥ 实验室用5%过氧化氢溶液和二氧化锰制取氧气,
充分反应后得到0.05mol氧气,请问至少需要多少g过氧化氢溶液?(根据化学方程式例式计算)
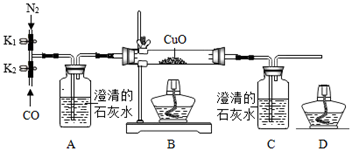
步骤Ⅰ:关闭K2打开K1 , 通入一段时间的N2;
步骤Ⅱ:关闭K1打开K2 , 通入CO,加热;
步骤Ⅲ:待B中固体全部变色时,停止加热;
步骤Ⅳ:……
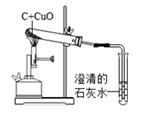
① 步骤Ⅰ通入氮气的目的是。
② B中反应的化学方程式是;
能够证明一氧化碳具有还原性的实验现象是 。
C中反应的化学方程式是。
③ 补全步骤Ⅳ的相关操作 。
④ 甲同学认为装置A可证明一氧化碳不能与石灰水发生反应,乙同学认为即使省略装置A,也可以达到相同的目的,你的观点和理由是 。
⑤D处酒精灯的作用。
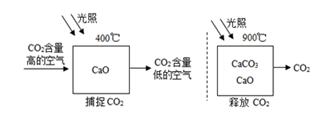
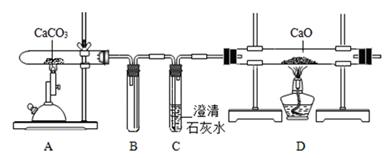
① 能证明装置A“释放CO2”的现象是,A中反应化学方程式。
② 装置 B在实验结束撤掉酒精喷灯时的作用是。
③ 实验后小组同学对D中固体的成分进行探究,以证明是否“捕捉”到CO2
D中的固体为: 猜想一:氧化钙;猜想二:氧化钙与碳酸钙;猜想三:碳酸钙
【设计并实验】
I. 甲同学取样D中固体于试管中,加入一定量的水,振荡,有白色不溶物,甲同学认为试管中的固体为碳酸钙,即猜想三成立。
乙同学认为上述实验不足以证明猜想三成立,其理由是。
II. 乙同学取样D中固体于试管中,加入少量的水,触摸试管外壁,感觉发热,认为固体中肯定有氧化钙,反应的化学方程式是,但无法确定是否有碳酸钙。
III. 丙同学认为利用感觉温度变化的方法判断是否有氧化钙不可靠,他利用水、酚酞试液和稀盐酸证明了猜想Ⅱ成立,请完成他的实验报告。
CaO+2HCl═CaCl2+H2O Ca(OH)2+2HCl═CaCl2+2H2O
|
实验步骤 |
实验现象 |
实验结论 |
|
取样,加入适量的水溶解,过滤,向滤液中滴入酚酞; 向滤渣中加入 |
|
猜想二成立。 |