![]()
 的说法,错误的是( )
的说法,错误的是( )
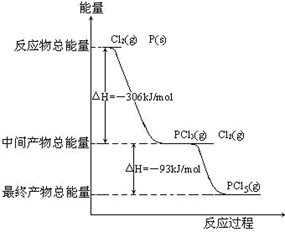
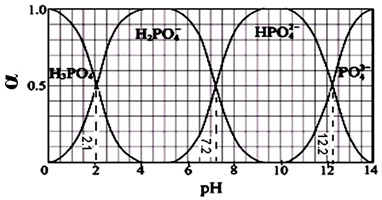
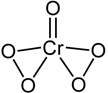
根据以上信息,下列判断正确的是( )
A 化合物 B 的官能团是醛基 B 反应①的目的是为了保护酚羟基
C 化合物 D 能发生消去反应 D 阿莫西林的分子式是 C16H19N3O5S
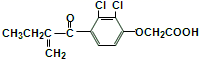
 为原料制备水杨酸(
为原料制备水杨酸(  )的合成路线 (用流程图表示,无机试剂任选)。
)的合成路线 (用流程图表示,无机试剂任选)。
①分子中有苯环且是苯环的对位二取代物
②分子中含有硝基且不与苯环直接相连
③分子不与金属钠反应放出氢气



实验步骤如下:
步骤 1:按如图组装好仪器,准确称取样品 a g (约 0.5g) 于蒸馏烧瓶中,加入约 150mL 水溶解。
步骤 2:准确量取 40.00mL 约 0.1 mol·L-1H2SO4 溶液于锥形瓶中。
步骤 3:经滴液漏斗向蒸馏瓶中加入 20mL3mol•L-1NaOH 溶液。
步骤 4:加热蒸馏至蒸馏烧瓶中剩余约 100mL 溶液。
步骤 5:用新煮沸过的水冲洗冷凝装置 2~3 次,洗涤液并入锥形瓶中。
步骤 6:向锥形瓶中加入酸碱指示剂,用 c mol·L-1NaOH 标准溶液滴定至终点,记录消耗NaOH 标准溶液的体积。
步骤 7:将实验步骤 1-6 重复 2 次。记录消耗 NaOH 标准溶液的平均体积为 V1 mL
步骤 8:在步骤 1 中不加入样品,将实验步骤 1-6 重复 3 次。记录消耗 NaOH 标准溶液的 平均体积为 V2 mL。
请回答:
①步骤 2 中,准确量取 40.00mL H2SO4 溶液的玻璃仪器是。
②为确保氨气被充分吸收的实验步骤为,为提高氨的吸收率,本实验还缺少的一步实验的步骤为
③请用含字母的表达式表示(如果有数字,请化简成一个数字)样品中 NH4ClO4 的含量。
已知:2I2 (s)+5O2 (g)=2I2O5 (s) △H=﹣75.56kJ·mol-1
2CO (g)+O2 (g)=2CO2 (g) △H=﹣566.0kJ·mol-1
写出 CO (g)与 I2O5 (s)反应析出固态 I2 的热化学方程式:,若这个反应一定能自发进行,则反应的△S0(填“>”,“<”或 “=”);
已知:Ⅰ、S2O82-+2I-=2SO42-+I2(慢) Ⅱ、I2+2S2O32-=2I- +S4O62-(快)
①向 KI、Na2S2O3 与淀粉的混合溶液中加入一定量的 K2S2O8 溶液,当溶液中的耗 尽后,溶液颜色将由无色变成为蓝色。 请从碰撞理论的角度解释上述产物未耗尽前溶液中看不到蓝色的原因:
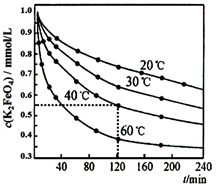
②为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
|
实验 序号 |
体积 V/mL |
||||
|
K2S2O8 溶液 |
水 |
KI 溶液 |
Na2S2O3 溶液 |
淀粉溶液 |
|
|
ⅰ |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
|
ⅱ |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
|
ⅲ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
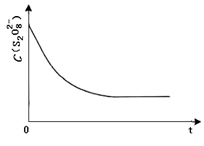
表中 Vx=mL,理由是。
③已知某条件下,浓度 c (S2O82-)~反应时间 t 的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时 c (S2O82-)~t 的变化曲线示意图 (进行相应的标注)