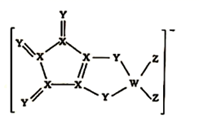
 D . 乙炔分子中σ键与π键个数比为1:2
D . 乙炔分子中σ键与π键个数比为1:2
| | | | |
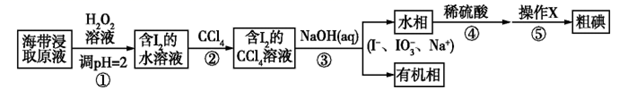
| A.推断C、Si、Cl的非金属性强弱 | B.灼烧海带以提取海带中的碘 | C.探究温度对平衡2NO2 | D.验证溴乙烷的消去产物是乙烯 |
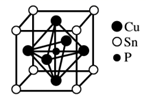
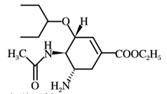
| 选项 | 实验 | 现象 | 结论 |
| A | 某溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中含有Fe2+ , 无Fe3+ |
| B | 向某溶液中滴加浓NaOH溶液,加热 | 产生的气体能使湿润的蓝色石蕊试纸变红 | 原溶液中含有 |
| C | 先向某溶液中加入BaCl2溶液,再加足量盐酸 | 开始产生白色沉淀,后沉淀不溶解 | 原溶液中含有 |
| D | 用洁净的铂丝蘸取某溶液在酒精灯上灼烧,透过钻玻璃观察 | 火焰呈紫色 | 原溶液中含有K+ |
| 温度(K) | 化学平衡常数 | ||
| 反应I:4NH3+5O2 | 反应II:4NH3+3O2 | 反应III:2NO+O2 | |
| 500 | 1.1×1026 | 7.1×1014 | 1.3×102 |
| 700 | 2.1×1019 | 2.6×1025 | 1.0 |
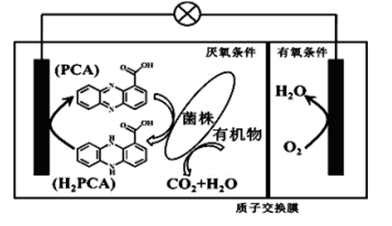
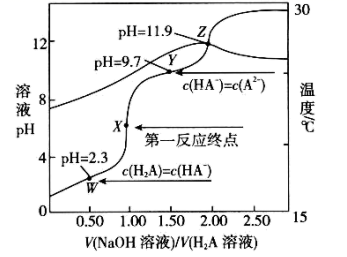
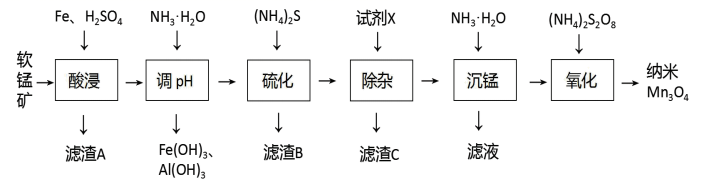
I.难溶物的Ksp如表:
| 物质 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Zn(OH)2 | ZnS | MnS | CaF2 |
| Ksp | 4.0×10-38 | 4.5×10-33 | 1.9×10-13 | 2.0×10-15 | 1.6×10-24 | 2.5×10-13 | 4.0×10-11 |
II.Mn(OH)2+xNH3=[Mn(NH3)x]2++2OH-
回答下列问题:
|
pH |
氨水体积/mL |
残余率/% |
沉降率/% |
|
8.5 |
2.7 |
71.1 |
28.9 |
|
9.0 |
4.5 |
45.2 |
54.8 |
|
9.5 |
7.6 |
20.5 |
79.5 |
|
10.0 |
10.5 |
16.3 |
83.7 |
|
10.5 |
16.1 |
18.4 |
81.6 |
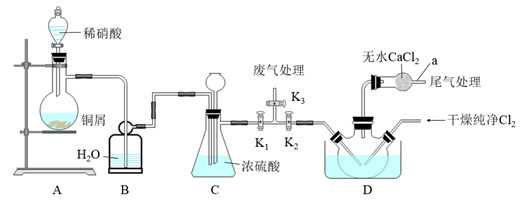
回答下列问题:

|
物质 |
Ag2CrO4 |
AgCl |
AgI |
Ag2S |
|
颜色 |
砖红色 |
白色 |
黄色 |
黑色 |
|
Ksp |
1×10-12 |
1.56×10-10 |
8.3×10-17 |
6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00mL,亚硝酰氯(ClNO)的质量分数为。(保留三位有效数字)
C2H4(g)+H2O(l) C2H5OH(l) △H=-44.2kJ•mol-1
2CO2(g)+2H2O(l) CH4(g)+3O2(g) △H=+1411.0kJ•mol-1
已知2CO2(g)+3H2O(l) C2H5OH(l)+3O2(g)其逆反应的活化能为EakJ•mol-1 , 则正反应的活化能为kJ•mol-1。

①三个反应中活化能最低的是(填“反应I”,“反应II”,“反应III”)。
②已知反应III在a点时已达平衡状态,则a点的平衡常数K=。
③b点v(正)v(逆)(填“﹥”,“﹤”,“=”)。
④a点的转化率比c点高的原因可能是。(写出一条即可)

①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式。
②根据图示,写出总反应的化学方程式:。

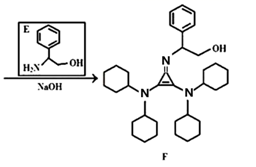
已知如下信息:
①H2C=CH2
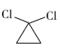
②  +RNH2
+RNH2
![]()
回答下列问题: