实验一 | 实验二 | 实验三 | |
实验操作 | 将钯丝伸入稀盐酸 | 将银丝伸入PdCl2溶液 | 将铂丝伸入PdCl2溶液 |
实验现象 | 无明显现象 | 银丝表面析出固体 溶液中出现白色沉淀 | 无明显现象 |
由上述现象可知,钯在金属活动性顺序中位于( )


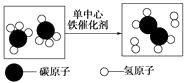 y
y
据实验现象,该固体最可能是( )
|
实验步骤 |
实验现象 |
|
检测水中加入固体前后液体的pH |
固体不溶解,液体的pH几乎没变化 |
|
检测盐酸中加入固体前后溶液的pH |
固体溶解,无气体放出,溶液pH增大 |
|
固体灼热状态下,通入纯净CO |
固体质量减轻,尾气中只检测到CO与CO2 |
①“王水”溶解黄金是化学变化; ②金比氢活泼; ③HAuCl4中,Au的化合价为+3价;④可以将pH试纸伸入“王水”中测其酸碱度;
亚硝酸钠(NaNO2) | 氯化钠(NaCl) | |
跟稀盐酸作用 | 放出红棕色的气体 | 无反应 |
跟硝酸银溶液作用 | 生成浅黄色沉淀 | 生成白色沉淀 |
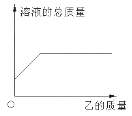
序号 | 甲 | 乙 |
A | HCl溶液 | NaOH溶液 |
B | HCl溶液 | 大理石 |
C | BaCl2溶液 | Na2CO3溶液 |
D | CuSO4溶液 | 铁 粉 |

写出上述反应的化学方程式 , 分析该反应前后,化合价发生改变的元素是。

【查阅资料】
①通常状况下,1体积水能溶解1体积二氧化碳;
②CO2在酸性溶液中溶解性会大大降低,若向溶有CO2的水溶液中加入盐酸, 会将CO2从水中赶出,观察到溶液中有气泡。
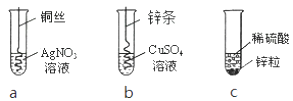
A.氯化钡溶液 B.氢氧化铜 C.氢氧化钠溶液 D.锌粒
【提出问题】E溶液的成分是什么?
【提出猜想】Ⅰ:NaOH溶液; Ⅱ:Na2CO3溶液;
Ⅲ:Na2SO4溶液; Ⅳ:NaCl溶液
【验证猜想】按如下步骤进行
步骤一 | 步骤二 | 步骤三 |
|
|
|
【分析与推理】
【反思与评价】最终判断出E瓶是NaOH溶液。张平同学认为D、E试剂瓶都需要密封保存。请用化学方程式来说明D瓶需要密封保存的原因。
方案1:称量混合物A的总质量和干燥的沉淀B或CaCl2固体的质量,并进行计算;
方案2:称量混合物A的总质量和实验改进后所得纯净氯化钠固体的质量,并进行计算。
请你判断:上述所选称量数据不合理的是(填:“方案1”或“方案2”)。
理由是。

①取研碎后的钙片4g,倒入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐酸,置于电子天平上测出装置总质量;
②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量;
③整理相关数据如下表,计算出钙片中碳酸钙的质量分数。(该实验中,装置中的固态干燥剂能吸水但不吸收二氧化碳)
反应前总质量/g | 275.58 |
反应后总质量/g | 274.92 |
反应前后质量差/g | 0.66 |
容器内气体质量差/g | m |
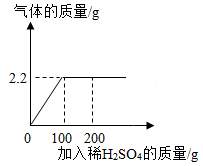

装置丙 | 装置丁 | |
反应前 | 48.8g | 161.2g |
反应后 | 46.5g | 163.9g |
小明根据装置丙减少的质量就是氧元素质量,求得氧化铜的质量为g,氧化铜的纯度为%。