 图中:如果MnO2过量,浓盐酸就可全部消耗
B .
图中:如果MnO2过量,浓盐酸就可全部消耗
B . 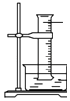 图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气
C .
图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气
C .  图中:生成蓝色的烟
D .
图中:生成蓝色的烟
D . 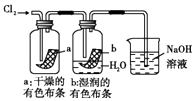 图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
①Cl2→Cl+Cl
②Cl+H2→HCl+H
③H+Cl2→HCl+Cl
…
反应②中形成的化合物的电子式为;反应③中被破坏的化学键属于键(填“极性”或“非极性”).
a. I与
I互为同位素
b.加碘食盐能使淀粉溶液变蓝
c.从海带中提取I2的过程只发生化学变化
d.提纯含泥沙的粗碘可用升华法.
已知:氧化性:IO3﹣>Fe3+>I2还原性:S2O32﹣>I﹣
反应式:3I2+6OH﹣═5I﹣+IO3﹣+3H2O,KI+I2⇌KI3
①该红色物质是(用化学式表示);CCl4中显示紫红色的物质是(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为;
将I2溶于KI溶液,在低温条件下,可制得KI3・H2O.该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由:.
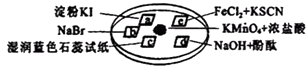
KMnO4+ HCl(浓)═ KCl+ Cl2↑+ MnCl2+ H2O