
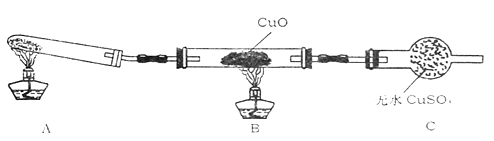
该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是。
因铜不能与稀硫酸反应,实验中用铜和浓硫酸加热使之完全反应,将溶液通过蒸发、结晶等操作得到硫酸铜晶体。
根据上述实验和反应,比较浓硫酸与稀硫酸的性质,浓硫酸具有。
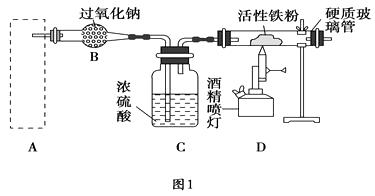
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太慢,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
Fe2(SO4)3的作用是。
实 验 (一) | 实 验 (二) | |
主要优点 | 操作简便 | ⑴原料充分转化为产品 ⑵没有有害气体排放 |
主要缺点 |

② 若洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量(填“偏高”、“偏低”或“无影响”).
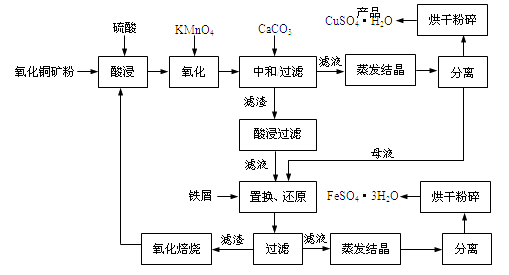
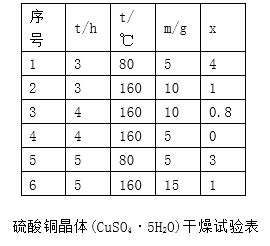
表中m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水个数。据此可确定由CuSO4·5H2O脱水得流程所示产品的适宜工艺条件为(指出条件的温度和时间)。