| 选项 | 实验目的 | 实验方案 |
| A | 配制100mL1.0mol/LCuSO4溶液 | 将25g CuSO4·5H2O溶于100mL蒸馏水中 |
| B | 除去CuO中混有的Al2O3 | 加入过量NaOH溶液后,过滤、洗涤、干燥 |
| C | 证明氧化性:H2O2>Fe3+ | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| D | 证明非金属性:Cl>C | 向NaHCO3溶液中加入过量盐酸振荡、静置、观察 |
Ⅰ.原子半径:甲<丙<乙<丁
Ⅱ.原子的最外层电子数:甲+丙=乙+丁=8
Ⅲ.原子的核外电子层数:丁>乙=丙=2甲
Ⅳ.乙元素的主要化合价:最高正价+最低负价=2
则下列说法错误的是( )


| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |

已知: 的沸点为
,固体杂质不参与反应。
第一阶段:将粗镍与 反应转化成气态
;
第二阶段:将第一阶段反应后的气体分离出来,加热至 制得高纯镍。
下列判断正确的是( )


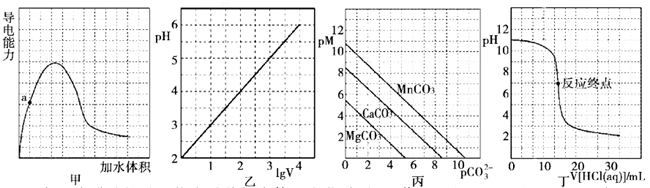
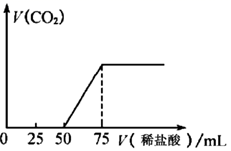
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是(填写化学式)
②滴入 稀盐酸过程中,溶液导电性(填“增强”或“减弱”),试解释其原因。
③原 氢氧化钠溶液的浓度为。

已知:煅烧时, 发生的反应为:

通过冷却结晶能析出大量 的原因是。
受热易分解,用如图装置加热
固体,试管内有红棕色气体生成,一段时间后,在末端导管口可收集到无色气体a。

气体a的名称是。
①
由合成气——水煤气也可以分两步制备二甲醚
②
③
已知:
| 物质 | | |
| 燃烧热 | 890.3 | 1453 |
并且 液态水变成气态水吸收
的热量。则
。
a.反应容器中二甲醚的百分含量不变 b.混合气体的密度不变
c. 不变 d.分压平衡常数
不变
e. f.混合气体的压强不变
在体积可变的密闭容器中投入 和
,在不同条件下发生反应:
。实验测得
的物质的量随温度、压强的变化如图3所示。
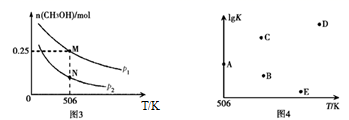
①该反应自发进行的条件是(填“低温”、“高温”或“任意温度”)。
② 时,压强为
反应平衡时
的转化率为;压强:
(填“>”、“<”或“=”)。
③反应速率:N点 M点
(填“>”、“<”或“=”)。
④若压强为 、在
恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数
如图4所示。则温度为
时,平衡常数
(保留三位小数),B、C、D、E四点中能正确表示该反应的
与T的关系的点为。