| 选项 | 传统文化 | 化学角度解读 |
| A | 兰陵美酒郁金香,玉碗盛来琥珀光 | “香”主要因为美酒含有酯类物质 |
| B | “司南之杓(勺),投之于地,其柢(勺柄)指南” | 司南中“杓”的材质为Fe2O3 |
| C | 三月打雷麦谷堆 | 在雷电作用下N2转化成能被作物吸收的氮元素 |
| D | 《本草经集注》记载“如握盐雪不冰,强烧之,紫青烟起…云是真硝石也 | 利用物理方法(焰色反应)可以检验钠盐和钾盐 |
①糖类、油脂、蛋白质都是高分子化合物,适当条件下均可发生水解
②油脂、乙酸乙酯都是酯类,但不是同系物
③石油的分馏,煤的气化、液化、干馏等过程均为化学变化
④蛋白质的变性和盐析都不是可逆过程
⑤塑料、橡胶和纤维都是天然高分子材料
①金属钠投入FeCl3溶液中; ②过量NaOH溶液和明矾溶液混合;
③少量Ca(OH)2投入过量NaHCO3溶液中; ④向AlCl3溶液中滴入NaHCO3溶液;
⑤向饱和Na2CO3溶液中通入足量CO2

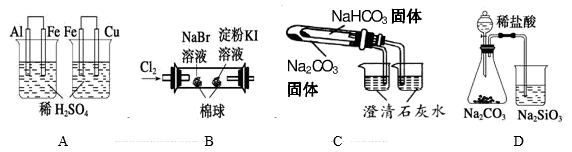
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2已经变质 |
| B | 乙酸乙酯与NaOH溶液共热、搅拌 | 液体不再分层 | 乙酸乙酯在碱性条件下完全水解生成溶于水的物质 |
| C | 向黄色的Fe(NO3)3溶液中滴加氢碘酸 | 溶液变为黄褐色 | 氧化性:Fe3+>I2 |
| D | 微热滴加了酚酞的NaHCO3溶液 | 溶液红色加深 | NaHCO3分解产生Na2CO3 |
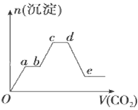
用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
在第2份溶液中加入新制的氯水和
,振荡后静置,下层溶液显橙红色。
则下列推断正确的是( )

请你根据上图推断:
A.1mol羟苯水杨胺最多可以和2 molNaOH反应
B.不能发生硝化反应
C.可发生水解反应
D.可与溴发生取代反应
①参加反应的氧化剂与还原剂的物质的量之比为。
②若有2molFe2+被氧化,则被Fe2+还原的O2的物质的量为mol。
③每生成1molFe3O4 , 反应转移的电子为mol。

已知NaHCO3在低温下溶解度较小。
反应Ⅰ的化学方程式为。

装置丙中冷水的作用是;由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有、洗涤、灼烧。
