
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2 , NO2在上述过程中体现了什么样的性质或起了什么作用:①氧化性;②还原性;③催化剂;④酸性
| A. | B. | C. | D. | |
| 含杂物质 | 乙酸乙酯(乙酸) | 酒精(水) | 乙烯(二氧化硫) | 溴苯(溴) |
| 除杂试剂 | NaOH溶液 | 生石灰 | 酸性KMnO4溶液 | 四氯化碳 |
| 分离方法 | 分液 | 蒸馏 | 洗气 | 分液 |
甲:500 ℃,10 mol SO2 和 5 mol O2 的反应
乙:500 ℃,用 V2O5 作催化剂,10 mol SO2 和 5 mol O2 的反应
丙:450 ℃,8 mol SO2 和 5 mol O2 的反应
丁:500 ℃,8 mol SO2 和 5 mol O2 的反应
①原气体中肯定有SO2 ②原气体中可能有SO2 ③原气体中肯定无H2S、HBr、NO2④不能肯定是否含有HCl ⑤原气体中肯定不含CO2 ⑥原气体中肯定含HCl

| | | | |
| A.制取并检验氨气 | B.形成喷泉且瓶内物质的量浓度相等 | C.液体分层,下层呈紫色 | D.检验产物SO2 |

①Zn电极为原电池的极(填“正”或“负”),电极反应式是。
②Cu电极上发生的反应属于(填“氧化”或“还原”)反应,当铜表面析出4.48 L氢气(标准状况)时,导线中通过了mol电子。
③能证明化学能转化为电能的实验现象是:铜片上有气泡产生、。
A CaO+H2O=Ca(OH)2
B 2H2+O2=2H2O
C 2FeCl3+Cu=CuCl2+2FeCl2

|
时间/min |
1 |
2 |
3 |
4 |
5 |
|
氢气体积/mL |
50 |
120 |
232 |
290 |
310 |
①在0~1、1~2、 2~3、3-4、4~-5min各时间段中:
反应速率最大的时间段是 min,主要的原因可能是。
反应速率最小的时间段是 min,主要的原因可能是。
②为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入(填序号)。
a Na2CO3溶液 b NaOH溶液 c 稀HNO3 d 蒸馏水
实验I:

实验II:另取两支试管分别加入5 mL5%H2O2溶液和5mL10%H2O2溶液,均未观察到有明显的气泡产生。
①双氧水分解的化学方程式是。
②实验I的目的是。
③实验II未观察到预期现象,为了达到该实验的目的,可采取的改进措施是。
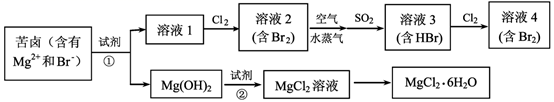
反应②:。
反应④:。
