 B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
①尿素的化学式为 ,它属于化肥中的(选填“氮肥”、“磷肥”或“钾肥”)同时它还属于(选填“有机物”或“无机物”)。它的摩尔质量为,1mol
中约含有个碳原子,含有g 氮元素。
②1828 年维特首次使用无机物氰酸铵与 人工合成了
,
是由铵根和组成的,无机物氰酸铵中氰酸根一定含有元素。
|
温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
|
KNO3的溶解度(g/100g 水) |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
I分别取 20.0gKNO3 固体和 10.0mL 蒸馏水,放入烧杯中,充分搅拌,并冷却至室温。
II观察固体是否完全溶解,若还有固体剩余,可进行操作去除不溶物,并称量剩余溶液的质量;若没有固体剩余,直接称量溶液的质量。
②III为了使固体完全溶解,依次将操作 I 中蒸馏水的体积由 10mL 改为 20.0mL、30.0mL、40.0mL……,重复上述操作 I、II,直至固体完全溶解。记录实验数据,绘制图。

A点对应的溶液中KNO3的质量为g,此时 KNO3的溶解度为g/100g 水,此时温度的范围是(选填字母)。
a.0~10℃ b.10~20℃ c.20~30℃ d.30~40℃
③A、B、C、D、E五点对应的溶液中,属于不饱和溶液的是(选填字母)。
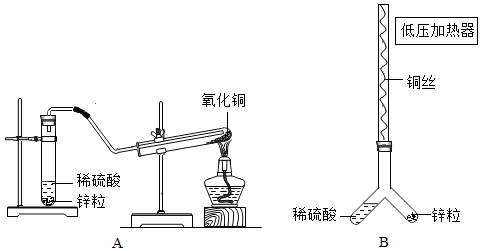
①装置A 开始反应,锌粒表面的现象为,该反应的化学方程式为。充分反应后,可以观察到氧化铜表面的现象为,说明氢气具有还原性,该反应的化学方程式为。
②装置 B 的实验操作顺序如下:
I.制氧化铜:打开低压加热器,加热铜丝,发现铜丝表面变黑后停止加热,此时铜丝表面反应的化学方程式为。
II.制氢气:必须待铜丝冷却至室温,才能倾斜装置使稀硫酸流入锌粒,开始反应,理由是。
III.反应:应先对产生的气体进行操作后,再打开低压加热器,加热铜丝,直至铜丝表面黑色物质消失后停止加热,取出铜丝,停止反应。
③请选择一套合适的装置,并从实验装置和药品的角度阐述你的理由。
①取少量胆矾于蒸发皿中,用酒精灯充分加热,现象为。
求 0.02mol 胆矾完全反应后,蒸发皿中剩余的固体的质量(请根据化学方程式列式计算)。
②测量 t℃时,饱和硫酸铜溶液的质量分数,进行如下实验操作: I 称量空蒸发皿的质量(m1g)。
II取一定量饱和硫酸铜溶液于蒸发皿中,称量饱和硫酸铜溶液与蒸发皿的质量(m2g)。
III用酒精灯充分加热,直至蒸发皿中固体完全变白。
IV待蒸发皿冷却至室温后,称量剩余固体与蒸发皿的质量(m3g)。实验结果及 CuSO4 的溶解度如表:
|
t |
m1 |
m2 |
m3 |
||
|
实验数据 |
18℃ |
36.7g |
97.1g |
47.1g |
|
|
温度(℃) |
10 |
20 |
|||
|
CuSO4 的溶解度(g/100g 水) |
17.4 |
20.7 |
|||
上述实验方案与结果是否合理,若合理,请计算该饱和硫酸铜溶液的质量分数;若不合理,请阐述你的理由。