 测溶液的pH
B .
测溶液的pH
B . 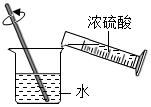 稀释浓硫酸
C .
稀释浓硫酸
C .  称量NaOH固体
D .
称量NaOH固体
D . 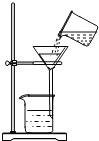 过滤
过滤


| 选项 | 实验目的 | 实验方法 |
| A | 除去KNO3固体中混有的NaCl | 加水溶解,蒸发结晶后过滤 |
| B | 鉴别Fe3O4、CuO、C三种黑色粉末 | 分别在空气中充分灼烧 |
| C | 鉴别NaCl、CaCO3两种白色固体 | 加入水 |
| D | 除去稀NaCl溶液中少量Na2CO3 | 加入过量CaCl2溶液 |
 向一定质量的稀硫酸中滴加水
B .
向一定质量的稀硫酸中滴加水
B .  向氢氧化钠和碳酸钠的混合溶液中滴加石灰水至过量
C .
向氢氧化钠和碳酸钠的混合溶液中滴加石灰水至过量
C .  向一定量的氢氧化钠和碳酸钠的混合溶液中逐滴滴加盐酸
D .
向一定量的氢氧化钠和碳酸钠的混合溶液中逐滴滴加盐酸
D .  将足量的锌、铁与等量的稀硫酸反应
将足量的锌、铁与等量的稀硫酸反应
a.贫血 b.甲状腺疾病
a.紫色石蕊试液 b.无色酚酞试液 c.pH试纸 d.蓝色石蕊试纸
a.氢氧化钠溶液 b.食盐水 c.肥皂水 d.食醋

a.A的饱和溶液和B的饱和溶液
b.A的不饱和溶液和B的饱和溶液
c.A的饱和溶液和B的不饱和溶液
d.A的不饱和溶液和B的不饱和溶液
a.一定有Ag、Cu、Zn
b.一定有Ag,可能有Cu、Zn
c.一定有Ag、Cu可能有Zn

A NaCl
B NaOH
C CaO


a、精盐不干燥
b、称量时精盐与砝码放反了
c、量取水时仰视读数
d、装瓶时,有少量溶液洒出
①实验中c加入过量的氢氧化钠溶液,发生反应的化学方程式为。
②在得到的滤液中加入足量X物质,该物质的化学式为。

③若实验过程中不考虑损耗,最终得到的NaCl固体的质量将(填“大于”、“小于”或“等于”)原精盐中NaCl的质量。
(实验探究1)取出容器底部剩余的固体物质,用水清洗后干燥,分成甲、乙两份备用。
|
实验操作 |
实验现象 |
解释与结论 |
|
用磁铁靠近固体物质甲 |
固体物质(填“能”或“不能”)被吸引 |
固体物质中不含铁单质 |
|
将固体物质甲放入20%的盐酸中 |
固体还渐消失,溶液变成黄色 |
固体物质主要是氧化铁,发生反应的方程式为。 |
(猜想假设)气体中除了可乐本身含有的CO2外,可能还有H2
(查阅资料)
①H2可以还原CuO,生成Cu和H2O。
②无水硫酸铜为白色固体,遇水变蓝。
③碱石灰主要成分固体CaO和NaOH
(实验探究2)将逸出气体依次通过如图的组合装置(假设每步反应均完全)。

①碱石灰的作用是。
②实验过程中观察到现象,证明逸出气体中含有氢气。
(提出问题)铁钉表面已变光亮,而容器底部有大量铁锈剩余的原因是什么?
(猜想假设)①可乐太少,酸性物质量不足。②可乐酸性弱,与铁锈反应太慢。
(实验探究3)取可乐与锈铁钉反应后的剩余液,测得溶液仍然呈酸性,猜想①不成立。
(查阅资料)3%的稀盐酸pH约为1,某品牌可乐的pH值为3.39,质量分数为3%的稀盐酸比该品牌可乐的酸性(选填“弱”或“强”)。
(实验结论)对比(实验探究1)和(实验探究4)的不同反应现象可得出:化学反应速率与反应物的有关。猜想②成立。
将(实验探究1)和(实验探究4)中废液混合,得到澄清溶液100.0g,通过氯离子检测仪测得氯元素质量分数为7.1%,从环保角度考虑,最好在废液中加入g氢氧化钠固体,充分反应,过滤后再将废液排放。
