
| 选项 | 试剂 | 现象 | 结论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | 品红溶液 | 溶液褪色 | SO2有漂白性 |
| C | NaOH溶液 | 无明显现象 | SO2与NaOH溶液不反应 |
| D | 硫化氢水溶液 | 溶液变浑浊 | SO2有还原性 |
| 选项 | 金属(粉末状) | 酸及其浓度 | 酸的体积/mL | 反应起始温度/℃ |
| A | 0.1 mol Zn | 6 mol·L-1硝酸 | 10 | 50 |
| B | 0.1 mol Fe | 3 mol·L-1硫酸 | 20 | 30 |
| C | 0.1 mol Zn | 3 mol·L-1硫酸 | 10 | 30 |
| D | 0.1 mol Zn | 3 mol·L-1盐酸 | 40 | 30 |
| 选项 | A | B | C | D |
| 反应装置或图像 | | | | |
| 实验现象或图像信息 | 温度计的水银柱上升 | 反应物总能量大于生成物总能量 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲处液面低于乙处液面 |
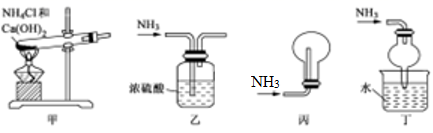
①浓硫酸和浓硝酸在空气中敞口放置时浓度均减小
②二氧化硫和氯气均能使品红溶液褪色
③双氧水和活性炭使色素褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁制容器存放、浓硝酸能用铝罐车运输
⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
⑦二氧化碳、二氧化硫使澄清石灰水变浑浊

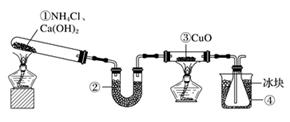
①升温 ②增加C的量 ③将容器的体积缩小一半 ④保持体积不变,充入He使体系压强增大 ⑤保持压强不变,充入He ⑥保持体积不变,充入水蒸气使体系压强增大
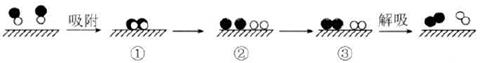
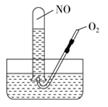
①试管内气体呈棕色 ②试管内气体呈无色 ③试管内液面不变
④试管内液面上升 ⑤试管内气体是O2
⑥试管内气体是NO。其中正确的是( )


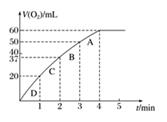
计算:
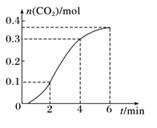
5 min末A的物质的量浓度为,A的转化率为。
①v(A)=5 mol·L-1·min-1 ②v(B)=6 mol·L-1·min-1
③v(C)=0.2 mol·L-1·s-1 ④v(D)=8 mol·L-1·min-1
其中反应速率最快的是(填序号)。
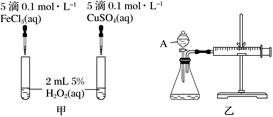
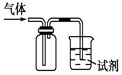
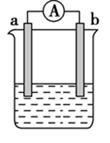
若利用图甲装置,可通过观察现象,从而定性比较得出结论。
①铝片和稀盐酸的反应;②Ba(OH)·8H2O和NH4Cl反应;
③甲烷在氧气中燃烧;④将胆矾加热变为白色粉末;⑤酸碱中和反应;
⑥碘的升华;⑦NaOH固体溶于水;⑧氢气还原氧化铜
| 化学键 | | 氧氧键 | | |
| 能量/( | a | 498 | 946 | 391 |
回答下列问题:
①( 与
反应生成
和
放出的能量为
。
② 与
断键吸收的能量为
。
③ 。
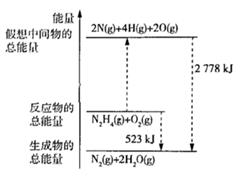
④当有 (l)生成时,放出的能量(填“>”“<”或“=”) 523kJ.
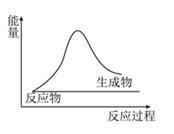
反应A:
已知:①.反应A中
被氧化,放出
的热量。
②. 
断开
键与断开
键所需能量相差
。水分子中H-O键比氯化氢分子中H-Cl键(填“强”或“弱”)。