
| 选项 | A | B | C | D |
| 实验装置 | | | | |
| 实验目的 | 用NaOH标准液滴定盐酸(锥形瓶中) | 除去CO2气体中混有的HCl杂质 | 由CuSO4溶液制取胆矾 | 检查装置气密性 |
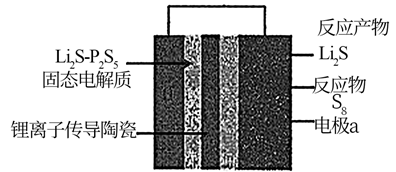

下列说法错误的是( )


A.升温 B.采用高压氧酸浸 C.使用98%的浓硫酸 D.将矿石粉碎成小块
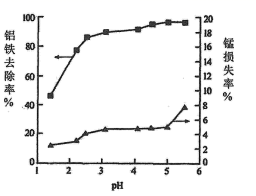
A.1~2 B.2~3 C.3~4 D.4~5
已知在此条件下Mn2+不会产生沉淀,推测锰元素损失的可能原因是。
|
化学键 |
Cl-Cl |
C-Cl |
C | C=O |
| E/(kJ·mol-1) | 243 | 330 | 1076 | 765 |
写出工业上采用高温活性炭催化CO与Cl2合成COCl2(g)的热化学反应方程式。
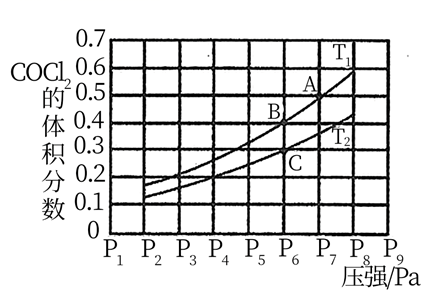
①有利于提高光气(COCl2)平衡产率的反应条件是。
②图中A点和C点化学平衡常数的大小关系:KAKC(填“大于”,“小于”或“等于”)理由是。若用压强平衡常数Kp表示,计算B点对应的Kp=(用含p6的式子表示)(Kp为压强平衡常数,用平衡分压代替平衡浓度计算,气体平衡分压=总压x气体体积分数)
v= k(Cl2)c(H2) ,可推测反应决速步中活化络合物的可能存在形式为ClH2或H2Cl或者H2+Cl。
Cl2=2Cl 反应I
Cl+CO=COCl 反应II
COCl+Cl2=COCl2+Cl 反应III
①该反应的活化络合物应为。
②CO与Cl2合成COCl2的决速步为(“反应I”,“反应II”或“反应III”)
回答下列问题:
a.HClO b.H2SO4 c.HNO2 d.HNO3
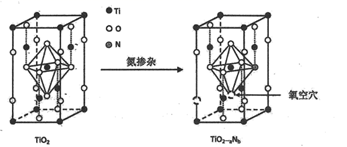
则TiO2-aNb晶体中a=,b=。
 )是制备冰染染料的重要中间体,请设计由苯酚制备4-甲氧基苯甲胺的合成路线(其他试剂任选) 。
)是制备冰染染料的重要中间体,请设计由苯酚制备4-甲氧基苯甲胺的合成路线(其他试剂任选) 。