
| | | | |
| I | II | III | IV |


已知:氯酸钠受热分解生成高氯酸钠和氯化钠。


①若高氯酸铵分解有氯气生成,则可能观察到C中的现象是,写出产生该现象的离子方程式。
②通过查阅资料:NH4ClO4在加热分解时还产生了一种使带火星木条复燃的气体。写出高氯酸铵分解的化学方程式。实验完毕后,取出E处硬质玻璃管中固体于试管中,滴加蒸馏水,产生的气体R能使湿润的红色石蕊试纸变蓝,R的电子式为。
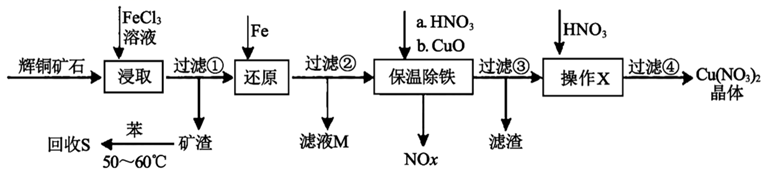
①回收S,温度控制在50℃~60℃之间,温度不宜过高或过低的原因分别是、。
②气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为;向滤液M中加入(或通入)下列 (填正确答案标号)物质,可得到另一种可循环利用的物质。
A.铁 B.氯气 C.高锰酸钾 D.盐酸
③保温除铁过程中加入CuO的作用是。
④操作X中硝酸溶液的作用是。
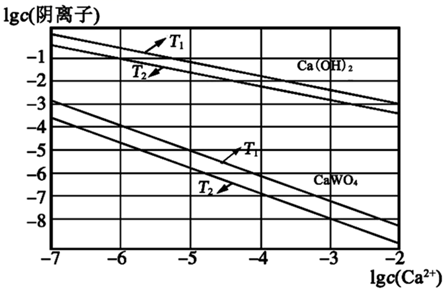
①T1T2(填“>”或“<”);T1时,Ksp(CaWO4)=。
②向钨酸钠溶液中加入石灰乳得到大量钨酸钙,发生反应的离子方程式为。
ⅰ.CO2(g)+H2(g) CO(g)+H2O(g)ΔH=+41.2kJ·mol-1
ⅱ.CO(g)+2H2(g) CH3OH(g)ΔH=-90.4kJ·mol-1
请写出CO2与H2反应生成CH3OH(g)的热化学方程式。
下列反应条件有利于提高CH4平衡转化率的是 (填正确答案标号)。
①1200K之前CO2的平衡转化率大于CH4可能的原因是。
②923K时,该反应在10min达到平衡,则0~10min内CH4的平均反应速率为 mol·L-1·min-1。


①多孔电极a为(填“阴极”或“阳极”)。
②若生成的C2H6和C2H4的体积比为1:1,则多孔电极b发生的反应为。
③当生成C2H6和C2H4各0.1mol时,转化的CH4和CO2的总体积在标准状况下是L。
②As4S4俗称雄黄,其中基态As原子的价电子排布式为,有个未成对电子。
③P、S、As电负性由大到小的顺序是。

①苯的二取代物且苯环上含有硝基;②可以发生水解反应。
上述同分异构体中核磁共振氢谱为3:2:2的结构简式为。
 的合成路线 (无机试剂任选)。
的合成路线 (无机试剂任选)。